ГЛАВА 14. ФОТОСИНТЕЗ. ТИПЫ ЖИЗНИ, ОСНОВАННЫЕ НА ФОТОФОСФОРИЛИРОВАНИИ
В предыдущей главе был рассмотрен ряд групп прокариот, относящихся к эубактериям, получающих энергию в реакциях субстратного фосфорилирования и не зависящих от молекулярного кислорода. Их предки появились на Земле, когда в ее атмосфере отсутствовал O2. Единственным источником свободной энергии, доступным первобытным организмам, была химическая энергия органических молекул, возникших в основном абиогенным путем. Увеличение численности популяций приводило к возрастанию использования органических молекул в окружающей среде, которое на определенном этапе стало превышать их накопление. В результате органические вещества постепенно исчерпывались из среды. Создавалась критическая ситуация, вызываемая нехваткой соединений, которые могли бы служить источником свободной энергии для организмов. Перед ними возникла проблема поиска новых источников углеродного питания и свободной энергии. В энергетическом плане необходимо было найти способ получения энергии за счет постоянно действующего источника. Такой источник энергии представляет собой солнечная радиация. Глобальное значение развившейся способности использовать световую энергию в том, что фотосинтез — единственный процесс, приводящий к увеличению свободной энергии на нашей планете. Таким образом, фотосинтез обязан своим "происхождением" экологическому кризису, возникшему в результате исчерпания на определенном этапе развития жизни органических ресурсов планеты.
Жизнь за счет анаэробных превращений органических субстратов привела к возникновению анаэробной формы жизни за счет света. Для этого прежде всего должны были возникнуть молекулы, поглощающие кванты света. Когда сформировались структуры для улавливания света, появилась возможность использования световой энергии. То, как эта возможность реализовывалась, доказывает наличие нескольких типов фотосинтеза, осуществляемого разными группами эубактерий, энергетический метаболизм которых полностью или частично основан на использовании энергии света. Фотосинтезирующие эубактерий представлены пурпурными и зелеными бактериями, гелиобактериями, цианобактериями51 и прохлорофитами.
51 В ботанической литературе — сине-зеленые водоросли.
ПИГМЕНТЫ ФОТОСИНТЕЗИРУЮЩИХ ЭУБАКТЕРИЙ
Для абиогенного синтеза органических веществ в основном требовался ультрафиолет. Все известные в настоящее время фотосинтезирующие организмы используют в процессе фотосинтеза видимый и инфракрасный свет. Наиболее богатые энергией ультрафиолетовые лучи в фотосинтезе практически не используются (см. рис. 35). Это связано с фотохимическими эффектами разных частей спектра, рассмотренными ранее.
Фотосинтезирующие эубактерий обязательно содержат магнийпорфириновые пигменты — хлорофиллы. Известно больше десяти видов хлорофиллов, но все они поглощают свет видимой и инфракрасной частей спектра.
Вероятно, первыми фоторецепторами, предшественниками современных хлорофиллов, следует считать порфирины, структура которых обеспечивает поглощение умеренно энергизованных квантов света. Экспериментально показана возможность синтеза порфиринов абиогенным путем из простых веществ в условиях, имитирующих условия первобытной Земли.
Важным моментом в эволюции порфиринов явилось включение ионов металла в центр порфиринового ядра. Все порфирины, обладающие фоторецепторным действием, являются магниевыми комплексами. Порфирины, участвующие в темновом транспорте электронов (цитохромы), а также ферменты каталаза и пероксидаза содержат в центре порфиринового кольца атом железа.
Итак, способность организмов существовать за счет энергии света в первую очередь связана с наличием у них специфических фоторецепторных молекул — пигментов. Набор пигментов характерен и постоянен для определенных трупп фотосинтезирующих эубактерий. Соотношения между отдельными пигментами колеблются в зависимости от вида и условий культивирования. В целом фотосинтетические пигменты эубактерий обеспечивают поглощение света с длиной волны в области 300 — 1100 нм.
Все фотосинтетические пигменты относятся к двум химическим классам соединений: 1) пигменты, в основе которых лежит тетрапиррольная структура (хлорофиллы, фикобилипротеины); 2) пигменты, основу которых составляют длинные полиизопреноидные цепи (каротиноиды). Особенность химического строения молекул всех фотосинтетических пигментов состоит в наличии системы сопряженных двойных связей52, от количества которых зависит способность пигментов улавливать бедные энергией кванты света, а также защита каротиноидами хлорофилла от синглетного кислорода.
52 Сопряженными называются двойные связи, чередующиеся с простыми, т. e. -CH=CH-СH=CH-.
Хлорофиллы
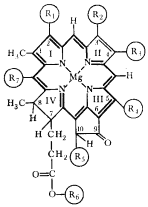
|
| Рис. 68. Обобщенная формула хлорофиллов. Римскими цифрами указаны пиррольные кольца. Химическая природа радикалов R1 — R7 приведена в табл. 19 |
У фотосинтезирующих эубактерий известно больше десяти видов хлорофиллов (рис. 68, табл. 19). Хлорофиллы эубактерий, осуществляющих бескислородный фотосинтез (пурпурные и зеленые бактерии, гелиобактерии) получили общее название бактериохлорофиллов. Идентифицировано 6 основных видов бактериохлорофиллов: а, b, с, d, e, g53. Все пурпурные бактерии содержат какую-либо одну форму бактериохлорофилла: a или b. Небольшие различия в химическом строении приводят к существенным изменениям в спектральных свойствах этих пигментов. Пурпурные бактерии, содержащие бактериохлорофилл a, могут поглощать свет с длиной волны до 950 нм. У видов, имеющих бактериохлорофилл b, максимум поглощения в красной части спектра сдвинут в длинноволновую область больше чем на 100 нм и приходится на 1020 — 1030 нм, а граница поглощения продвинута до 1100 нм. Дальше бактериохлорофилла b не поглощает ни один известный фотосинтетический пигмент. Основными хлорофилльными пигментами зеленых бактерий являются бактериохлорофиллы с, d или e, незначительно различающиеся между собой по спектрам поглощения (табл. 19). Кроме них в клетках всех зеленых бактерий в небольшом количестве содержится бактериохлорофилл a. Наличие этих бактериохлорофиллов позволяет зеленым бактериям использовать свет с длиной волны до 840 нм. Необычный бактериохлорофилл g с максимумом поглощения 790 нм обнаружен у облигатно анаэробных фотосинтезирующих бактерий Heliobacterium chlorum и Heliobacillus mobilis, выделенных в группу гелиобактерий.
53 Бактериохлорофиллы a, b и c, по последним данным, существуют в нескольких модификациях, так как радикал R6 может быть фитолом, фарнезолом, геранил-гераниолом или другим многоатомным спиртом (табл. 19).
Эубактерии, фотосинтез которых сопровождается выделением молекулярного кислорода (цианобактерии и прохлорофиты), содержат хлорофиллы, характерные для фотосинтезирующих эукариотных организмов. У цианобактерий — это хлорофилл a, единственный вид хлорофилла, обнаруженный в этой группе; в клетках прохлорофит — хлорофиллы a и b. Присутствие этих пигментов обеспечивает поглощение света до 750 нм.
Для всех хлорофиллов характерно наличие нескольких максимумов по глощения. В клетке спектральные свойства хлорофиллов определяются нековалентными взаимодействиями молекул пигмента друг с другом, а также с липидами и белками фотосинтетических мембран.
Фикобилипротеины
Таблица 19. Различия в химическом строении хлорофиллов фотосинтезирующих эубактерий и основные максимумы их поглощения в клетке
| Пигмент | Химическая природа радикалов, указанных на рис. 68 | Основной максимум поглощения в клетке, нм |
|||||||
| R1 | R2 | R3 | R4 | R5 | R6 | R7 | |||
| Хлорофилл | a | -CH=CH2 | -CH2 | -C2H5 | -CH3 | -CO-O-CH3 | фитол | -H | 680-685 |
| b | " | -COH | " | " | " | " | " | 650-660 | |
| Бактерио- хлорофилл |
a | -CO-CH3 | -CH3 | " | " | " | фитол или геранил-гераниол |
" | 830-890 |
| b | " | -CH3 | =CH-CH3 | " | " | " | " | 1020-1030 | |
| c | -CHOH-CH3 | " | -C2H5
-C3H7 -C4H9 |
-C2H5
-CH3 |
-H | фитол, фарнезол и др. |
-CH3 | 750-760 | |
| d | " | " | " | " | " | фарнезол | -H | 720-740 | |
| e | " | -COH | " | -C2H5 | " | " | -CH3 | 710-720 | |
| g | -CH=CH2 | -CH3 | =CH-CH3 | -CH3 | -CO-O-CH3 | " | -H | 770-790 | |
Фикобилипротеины — красные и синие пигменты, содержащиеся только у одной группы эубактерий — цианобактерий54. Хромофорная группа пигмента, называемая фикобилином, ковалентно связана с водорастворимым белком типа глобулина и представляет собой структуру, состоящую из четырех пиррольных колец, но не замкнутых, как в молекуле хлорофилла, а имеющих вид развернутой цепи, не содержащей металла (рис. 69). Молекулы фикобилипротеинов состоят из двух нековалентно связанных неидентичных субъединиц — a и b, к каждой из которых ковалентно присоединены хромофорные группы: фикоэритробилин или фикоцианобилин. Некоторые данные относительно строения и спектральных свойств фикобилипротеинов цианобактерий приведены в табл. 20.
34 Фикобилипротеины содержатся также у двух групп эукариот: красных и криптофитовых водорослей.
Таблица 20. Строение и спектральные свойства основных фикобилипротеинов цианобактерий
| Фикобилипротеин | Субъединичный состав мономера | Число и тип молекул хромофоров, связанных с субъединицами* | Состояние пигмента в клетке | Основной максимум поглощения, нм | |
| a | b | ||||
| Фикоэритрин | ab | 2ФЭБ | ЗФЭБ | (ab)n n=1-6 |
565 |
| Фикоцианин | ab | 1ФЦБ | 2ФЦБ | (ab)n n=1-6 |
620 |
| Аллофикоцианин Аллофикоцианин B |
ab | 1ФЦБ 1ФЦБ |
1ФЦБ 1ФЦБ |
(ab)3
(ab)3 |
654 671 |
* ФЭБ — фикоэритробилин; ФЦБ — фикоцианобилин.
Различия в спектральных свойствах фикобилипротеинов определяются аминокислотной последовательностью a- и b-полипептидов, числом и типом присоединенных к ним хромофорных групп, а также степенью агрегирования. Так, переход аллофикоцианина из мономерного состояния в гримерное сопровождается изменением максимума поглощения от 616 до 654 нм. Степень агрегирования зависит от вида и возраста культуры, а также от внешних факторов: pH, ионной силы раствора, температуры. В основе агрегирования молекул фикобилипротеинов лежат гидрофобные взаимодействия между мономерами. Значение способности фикобилипротеинов к агрегированию становится понятным при формировании ими фикобилисом — структур, в которых эти пигменты организованы в агрегаты высокого порядка.
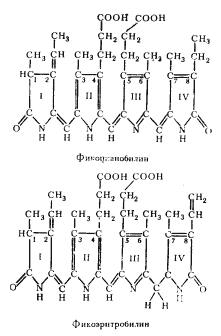
|
| Рис. 69. Химическая структура хромофорных групп фикоэритрина (фикоэритробилин), фикоцианина и аллофикоцианинов (фикоцианобилин). Римскими цифрами указаны пиррольные кольца (по Chapman, 1973) |
Фикобилипротеины обеспечивают в клетках цианобактерий поглощение света в области 450 — 700 нм и с высокой эффективностью (больше 90%) передают поглощенный свет на хлорофилл, при этом основное количество энергии передается на хлорофилл, связанный со II фотосистемой. Все цианобактерий содержат небольшие количества аллофикоцианина и его длинноволновой формы — аллофикоцианина B, а также значительные количества фикоцианина, одного из основных клеточных пигментов, содержание которого в условиях низкой освещенности может достигать 60% от общего уровня растворимых белков клетки. Некоторые цианобактерий содержат также второй основной фикобилипротеин — фикоэритрин. Способность синтезировать фикоэритрин может быть конститутивным свойством организма или индуцироваться в определенных условиях освещения.
Каротиноиды
К вспомогательным фотосинтетическим пигментам, которые содержат все фотосинтезирующие организмы, относятся каротиноиды, большая группа химических соединений, представляющих собой продукт конденсации остатков изопрена:
Большинство каротиноидов построено на основе конденсации 8 изопреноидных остатков. У некоторых каротиноидов полиизо- преноидная цепь открыта и не содержит циклических группировок. Такие каротиноиды называются алифатическими. У большинства на одном или обоих концах цепи расположено по ароматическому или (3-иононовому кольцу. Каротиноиды первого типа относятся к арильным, второго — к алициклическим. Выделяют также каротиноиды, не содержащие в молекуле кислорода, и кислородсодержащие каротиноиды, общее название которых ксантофиллы.
Состав каротиноидов фотосинтезирующих эубактерий разнообразен. Наряду с пигментами, одинаковыми у разных групп, для каждой из них обнаружены определенные каротиноиды или наборы последних.
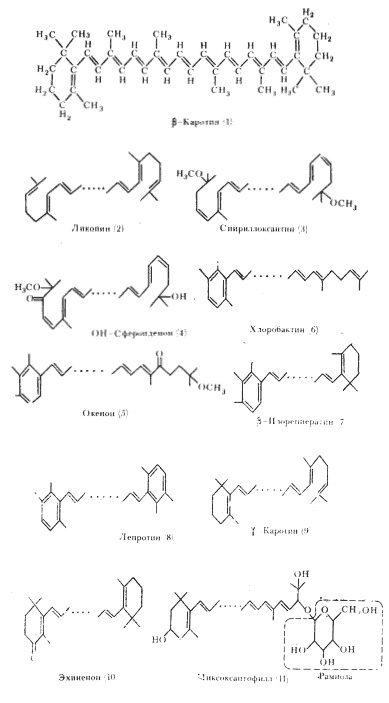
|
| Рис. 70. Структурные формулы некоторых каротиноидов фотосинтезирующих эубактерий (по Кондратьевой, 1972; Nichols, 1973) |
Наиболее разнообразен состав каротиноидных пигментов у пурпурных бактерий, из которых выделено свыше 50 каротиноидов. В клетках большинства пурпурных бактерий содержатся только алифатические каротиноиды, многие из которых принадлежат к группе ксантофиллов. У некоторых пурпурных серобактерий обнаружен арильный моноциклический каротиноид окенон, а у двух видов несерных пурпурных бактерий найдено небольшое количество (3-каротина, алициклического каротиноида, распространенного у цианобактерий и фотосинтезирующих эукариотных организмов. Структурные формулы некоторых характерных для пурпурных бактерий каротиноидов представлены на рис. 70, 2 — 5. Набор и количество отдельных каротиноидов определяют окраску пурпурных бактерий, густые суспензии которых имеют пурпурно-фиолетовый, красный, розовый, коричневый, желтый цвета.
Зеленые бактерии по составу каротиноидов отличаются от пурпурных. Основные каротиноиды зеленых серобактерий — арильные, содержащие 1 или 2 ароматических кольца, а также алициклический каротиноид g-каротин (рис. 70, 6 — 9). Иной состав каротиноидов у зеленых нитчатых бактерий. Эта группа эубактерий, цианобактерий и прохлорофиты содержат алициклические каротиноиды с одним или двумя b-иононовыми кольцами. Основной пигмент — b-каротин, составляющий иногда больше 70% общего количества каротиноидов клетки. Специфическим ксантофиллом этих групп является эхиненон, а также гликозидные производные некоторых кислородсодержащих каротиноидов типа миксоксантофилла (рис. 70, 1, 10, 11).
Каротиноидные пигменты поглощают свет в синем и зеленом участках спектра, т. е. в области длин волн 400 — 550 нм. Эти пигменты, как и хлорофиллы, локализованы в мембранах и связаны с мембранными белками без участия ковалентных связей. Функции каротиноидов фотосинтезирующих эубактерий многообразны. В качестве вспомогательных фотосинтетических пигментов каротиноиды поглощают кванты света в коротковолновой области спектра, которые затем передаются на хлорофилл. У цианобактерий энергия света, поглощенная каротиноидами, поступает в основном в I фотосистему. Эффективность передачи энергии для разных каротиноидов колеблется от 30 до 90%. Известно участие каротиноидов в осуществлении реакций фототаксиса, а также в защите клетки от токсических эффектов синглетного кислорода.
Спектры поглощения клеток разных групп фотосинтезирующих эубактерий
Пигментные наборы фотосинтезирующих эубактерий позволяют им использовать весь диапазон длин волн падающей на Землю солнечной энергии (рис. 71; см. рис. 35). Обращает внимание большое различие в спектрах поглощения у представителей разных групп фотосинтезирующих организмов и прежде всего существенные сдвиги в максимумах поглощения хлорофиллов в красной области спектра. Несомненно экологическое значение этого явления, позволяющего избегать конкуренции за свет между разными группами фотосинтезирующих организмов. Что же касается эволюции спектров поглощения хлорофиллов, то очевидна тенденция к перемещению в более коротковолновую часть спектра с более высоким энергетическим уровнем.
СТРОЕНИЕ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА ЭУБАКТЕРИЙ
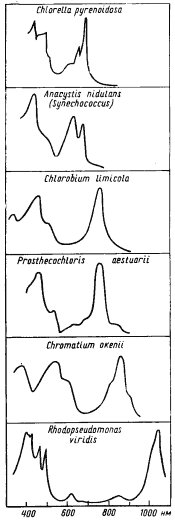
|
| Рис. 71. Спектры поглощения клеток эукариотной зеленой водоросли Chlorella pyrenoidosa и представителей разных групп фотосинтезирующих эубактерий: цианобактерии (Anacystis nidulans, Synechococcus), зеленых (Chlorobium limicola, Prosthecochloris aestuarii) и пурпурных (Chromatium okenii, Rhodopseudomonas viridis) бактерий |
Фотосинтетический аппарат основных групп эубактерий организован по-разному. Это проявляется как в химической природе составляющих его компонентов (набор пигментов, состав переносчиков электронов), так и в структурной организации в клетке. Фотосинтетический аппарат состоит из трех основных компонентов: 1) светособирающих пигментов, поглощающих энергию света и передающих ее в реакционные центры; 2) фотохимических реакционных центров, где происходит трансформация электромагнитной формы энергии в химическую; 3) фотосинтетических электронтранспортных систем, обеспечивающих перенос электронов, сопряженный с запасанием энергии в молекулах АТФ. В фотохимической реакции участвуют, как правило, хлорофиллы или бактериохлорофиллы a в модифицированной форме. Эти же виды хлорофиллов, наряду с другими, а также пигментами иных типов (фикобилипротеины, каротиноиды) выполняют функцию антенны. У некоторых пурпурных бактерий, содержащих только бактериохлорофилл b, он выполняет обе функции. У недавно описанных гелиобактерий бактериохлорофилл g также служит светособирающим пигментом и входит в состав реакционного центра (табл. 21).
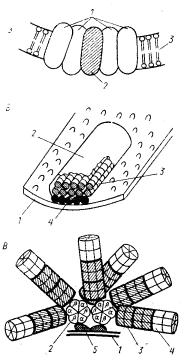
Два компонента фотосинтетического аппарата — реакционные центры и электронтранспортные системы — всегда локализованы в клеточных мембранах, представленных ЦПМ и у большинства фотосинтезирующих эубактерий развитой системой внутрицитоплазматических мембран — производных ЦПМ (см. рис. 4). Локализация светособирающих пигментов в разных группах фотосинтезирующих эубактерий различна (табл. 22). У пурпурных бактерий, гелиобактерий и прохлорофит светособирающие пигменты в виде комплексов с белками интегрированы в мембраны (рис. 72, А). В клетках зеленых бактерий и цианобактерий основная масса светособирающих пигментов находится в особых структурах, прикрепленных к поверхности мембраны, но не являющихся ее компонентом. Это хлоросомы зеленых бактерий и фикобилисомы цианобактерий (см. рис. 4).
В хлоросомах зеленых бактерий содержится весь бактериохлорофилл с, d или е (в зависимости от вида), а также небольшие количества бактериохлорофилла a, служащего промежуточным звеном при переносе энергии света от основного светособирающего бактериохлорофилла к бактериохлорофиллу a, локализованному в ЦПМ. С этой формы пигмента энергия света передается на модифицированную форму бактериохлорофилла a реакционного центра. Локализованные в хлоросомах светособирающие бактериохлорофиллы организованы в виде палочковидных структур диаметром 5 — 10 нм, расположенных параллельно длинной оси хлоросомы (рис. 72, Б). Высокоупорядоченная их организация и упаковка осуществляется с помощью белковых молекул. В основании хлоросомы, примыкающем к ЦПМ, расположен слой молекул бактериохлорофилла a.
Таблица 21. Функции пигментов в фотосинтезе
| Группы фотосинтезирующих эубактерий | Светособирающие пигменты | Хлорофиллы, входящие в состав реакционного центра | ||
| хлорофиллы | фикобилипротеины | основные каротиноиды | ||
| Пурпурные бактерии | бактериохлорофилл a или b | нет | алифатические и арильные | бактериохлорофилл a или b |
| Зеленые бактерии | бактериохлорофиллы a+с, a+d, a+e | нет | арильные и алициклические | бактериохлорофилл a |
| Гелиобактерии | бактериохлорофилл g | нет | единственный алифатический: нейроспорин | бактериохлорофилл g |
| Цианобактерии | хлорофилл a | фикоцианин, аллофикоцианин, фикоэритрин | алициклические | хлорофилл a |
| Прохлорофиты | хлорофиллы a+b | нет | алициклические | хлорофилл a |
Таблица 22. Локализация фотосинтетического аппарата в клетках разных групп эубактерий
| Группы фотосинтезирующих эубактерий | Компоненты фотосинтетического аппарата | |
| светособирающие пигменты | фотохимические реакционные центры и электронтранспортные системы | |
| Пурпурные бактерии | ЦПМ и ее производные | ЦПМ и ее производные |
| Зеленые бактерии | ЦПМ и хлоросомы* | ЦПМ |
| Гелиобактерии | ЦПМ | ЦПМ |
| Цианобактерии | фикобилисомы и тилакоиды** | тилакоиды** |
| Прохлорофиты | тилакоиды | тилакоиды |
* У недавно описанной бактерии Heliolhrix oregonensis, близкой по данным анализа 5S рРНК к нитчатым зеленым бактериям, обнаружен только один вид хлорофилла — бактериохлорофилл a и отсутствуют хлоросомы; все компоненты фотосинтетического аппарата этой бактерии локализованы в ЦПМ.
|
| Рис. 72. Структурная организация и локализация светсобирающих пигментов в разных группах фотосинтезирующих эубактерий: А — локализованные в мембране свет- собирающие комплексы пурпурных бактерий: 1 — светособирающие пигмент-белковые комплексы; 2 — реакционный центр; 3 — мембрана; Б — модель хлоросомы зеленых бактерий: 1 — ЦПМ; 2 — хлоросома; 3 — палочковидные структуры, образованные молекулами бактериохлорофилла с, d или е; 4 — слой молекул бактериохлорофилла a; В — модель типичной фикобилисомы цианобактерий: 1 — мембрана тилакоида; 2 — аллофикоцианиновое ядро; 3 — фикоцианин; 4 — фикоэритрин; 5 — белок, обеспечивающий прикрепление фикобилисомы к тилакоидной мембране |
** Исключение составляет Gloeobacter violaceus.
В группе цианобактерий обнаружены два типа структурной организации фотосинтетического аппарата. У единственного представителя этой группы — одноклеточной цианобактерии Gloeobacter violaceus — нет тилакоидных мембран и типичных для всех остальных видов фикобилисом. Единственной мембраной является ЦПМ, не образующая никаких впячиваний в цитоплазму. В ЦПМ локализованы реакционные центры и электронтранспортные системы фотосинтеза. Фикобилипротеины (фикоцианин, аллофикоцианины и фикоэритрины) в виде слоя толщиной 50 — 70 нм прилегают к внутренней поверхности ЦПМ.
Клетки всех остальных цианобактерий содержат развитую систему внутрицитоплазматических мембран — тилакоидов, к наружным поверхностям которых прикреплены регулярно расположенные дискретные гранулы — фикобилисомы. Их форма, размеры и количество на единицу поверхности мембраны могут меняться в значительных пределах, но всегда в клетках каждого вида содержатся фикобилисомы одного типа. Организация фикобилипротеинов в фикобилисомах показана на рис. 72, В. Молекулы аллофикоцианина и аллофикоцианина В составляют внутреннее ядро фикобилисомы. К нему примыкают расходящиеся в разные стороны палочковидные образования. построенные из агрегированных молекул фикоцианина и фикоэритрина, при этом фикоэритрин располагается на периферической части этих структур. У видов, у которых фикоэритрин отсутствует, палочковидные образования состоят только из фикоцианина. Такая организация фикобилисом в наилучшей степени обеспечивает перенос энергии возбуждения в направлении:

Помимо пигментов в составе фикобилисом найдены неокрашенные полипептиды, необходимые для высокоупорядоченной пространственной организации фикобилипротеинов в фикобилисоме, а также для прикрепления ее к мембране.
ФОТОФИЗИЧЕСКИЕ ПРОЦЕССЫ, ЛЕЖАЩИЕ В ОСНОВЕ ФОТОСИНТЕЗА
Известно, что энергия молекулы в основном определяется электронной энергией, а последняя, в свою очередь, зависит от расположения электронов на энергетических орбитах. Электрон, находящийся на более удаленной от ядра орбите, обладает большим запасом энергии, т. е. его энергетический уровень выше, чем у электрона, располагающегося на орбите ближе к ядру. Электроны могут переходить с одной электронной орбиты на другую, и это сопровождается потерей или поглощением извне энергии молекулой, т. е. изменением ее энергетического состояния. Подобные переходы имеют место и при поглощении или испускании молекулой кванта света. Способность вещества поглощать свет определенной длины волны зависит от его молекулярного строения и в первую очередь от расположения электронов на энергетических орбитах.
Каким требованиям должен удовлетворять свет как фактор для "возбуждения" электронов? Кванты света должны обеспечивать переходы электронов с низкоэнергетических на высокоэнергетические уровни. Это возможно в том случае, когда разница между энергетическими уровнями при переходе электрона с орбиты на орбиту равна энергии кванта света. Должны были образоваться такие вещества, в молекулах которых эти электронные переходы соответствуют энергии поглощенного кванта света. Подобным требованиям отвечают молекулы хлорофиллов и других пигментов, у которых переход электронов в возбужденное высокоэнергетическое состояние происходит под действием квантов света с длиной волны в диапазоне 300 — 1100 нм.
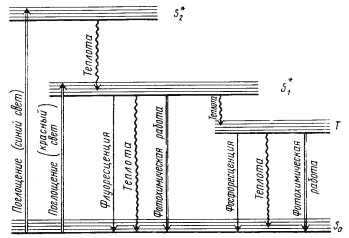
Рассмотрим процессы, происходящие при поглощении кванта света молекулой хлорофилла (рис. 73). В темноте молекула хлорофилла находится в стабильном невозбужденном состоянии, а ее электроны — на основном энергетическом уровне. Когда квант света попадает на молекулу хлорофилла, порция энергии этого кванта поглощается одним из электронов, который переходит на новый, более богатый энергией уровень, а молекула хлорофилла переходит при этом в возбужденное состояние. В зависимости от того, какова энергия поглощенного кванта, электрон может перейти на разные энергетические уровни: квант синего света поднимает электрон на второй синглетный уровень, квант красного света — на первый. Время жизни молекулы хлорофилла в возбужденных синглетных состояниях очень коротко (на втором синглетном уровне — 10 – 12 – 10 – 13 с, на первом — 10 – 9 — 10 – 7 с), после чего молекула возвращается в исходное стабильное состояние. Возвращение молекулы в исходное состояние возможно разными путями, и энергия, поглощенная электроном, теряется им в виде тепла, флюоресценции или фосфоресценции.
|
| Рис. 73. Схема электронных переходов между энергетическими уровнями молекулы хлорофилла при поглощении и испускании света: S0 — основной энергетический уровень S1* и S2* — первый и второй синглетные уровни; T — триплетный уровень (по Рубину, 1976) |
Перечисленные выше пути перехода молекулы хлорофилла из возбужденного состояния в основное не исчерпывают всех возможностей. В клетке молекулы хлорофилла в норме достаточно жестко сопряжены друг с другом, поэтому перешедшая в возбужденное состояние молекула пигмента может передавать энергию поглощенного кванта света соседней молекуле, переводя ее в возбужденное состояние. Основная масса хлорофилла и других фотосинтетических пигментов клетки представляет собой антенну, улавливающую световую энергию. Светособирающие пигменты организованы в виде комплексов, в которых они связаны с молекулами белка. Энергия возбуждения мигрирует в направлении от пигментов, поглощающих свет более коротких длин волн, к более длинноволновым формам и от последних поступает в реакционные центры. Для передачи энергии электронного возбуждения необходимо, чтобы среднее расстояние между молекулами пигментов составляло около 10Å.
|
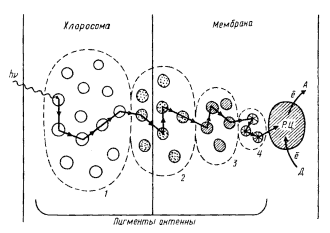
| Рис. 74. Миграция энергии света у зеленой бактерии Chloroflexus aurantiacus: 1 — бактериохлорофилл c; 2–4 — разные формы бактериохлорофилла a; Д — первичный донор электрона; А — первичный акцептор электрона; Р. Ц. — реакционный центр |
Поглощение и миграция энергии света у зеленой бактерии Chloroflexus aurantiacus схематически изображены на рис. 74. Порция энергии, поглощенная молекулой локализованного в хлоросоме бактериохлорофилла с (максимум поглощения пигмента — 742 нм), передается на форму бактериохлорофилла a с максимумом поглощения при 792 нм. Эта форма пигмента локализована как в хлоросоме, так и в мембране. С нее через расположенные в мембране более длинноволновые формы бактериохлорофилла а (максимум поглощения 805 и 865 нм) энергия поступает на модифицированную форму бактериохлорофилла a реакционного центра, поглощающую при 865 нм. Таким образом, процесс переноса энергии электронного возбуждения у C. aurantiacus может быть представлен в виде следующей цепочки:
У зеленых серобактерий на один реакционный центр приходится до 2000 молекул бактериохлорофилла с, a, или e; у некоторых пурпурных бактерий — порядка 50 молекул бактериохлорофилла a.
ФОТОХИМИЧЕСКИЕ ПРОЦЕССЫ И ПУТИ ЭЛЕКТРОННОГО ТРАНСПОРТА. ФОТОФОСФОРИЛИРОВАНИЕ
В то время как основная масса фотосинтетических пигментов способна только поглощать энергию света и передавать ее соседним молекулам, небольшая часть молекул хлорофилла участвует в осуществлении фотохимической реакции, т. е. преобразовании электромагнитной энергии в химическую. Процесс этот происходит в реакционных центрах, состоящих из первичного донора электронов, первичного акцептора и одного или более вторичных акцепторов электронов. Кроме того, в составе реакционных центров обнаружены молекулы каротиноидов и полипептидов. Основные компоненты реакционных центров разных групп фотосинтезирующих эубактерий представлены в табл. 23.
При поглощении кванта света реакционным центром первичный донор электронов (Д), которым всегда является длинноволновая форма молекулы хлорофилла или бактериохлорофилла, возбуждается, переходит в новое состояние (Д*), в котором становится активным восстановителем, и переносит электрон на первичный акцептор электронов (А). Чтобы предотвратить возвращение электрона на Д+, вторичный акцептор (В) принимает электрон от первичного акцептора и стабилизирует таким способом разделение зарядов. Для дальнейшей стабилизации этого разделения вторичный донор электронов (Е), в качестве которого почти всегда выступают цитохромы типа с, отдает электрон на молекулу первичного донора (Д+). Все перечисленные этапы можно суммировать следующим образом:
Эти реакции происходят в реакционном центре и являются "первичными" химическими реакциями фотосинтеза. Таким образом, индуцированные светом перемещения электрона в реакционном центре в конечном итоге приводят к переносу его на вторичный акцептор с отрицательным потенциалом.
Таблица 23. Реакционные центры эубактерий
| Группы фотосинтезирующих эубактерий | Состав реакционных центров | |||
| первичный донор электронов | первичный акцептор электронов | вторичный акцептор электронов | ||
| Пурпурные серные и несерные бактерии | бхл а (П870)
бхл b (П960) |
б/феоф а б/феоф b |
УХ MX |
|
| Зеленые бактерии | нитчатые | бхл a (П865) | б/феоф a | MX |
| серные | бхл a (П840) | бхл с (П663) | FeS | |
| Гелиобактерии | бхл g (П798) | бхл g (П670) | FeS Х-подобное соединение | |
| Цианобактерии | I ФС | хл а (П700) | хл а | FeS |
| II ФС | хл a (П680) | феоф a | ПХ | |
| Прохлорофиты | I ФС | хл а (П700) | ? | ? |
| II ФС | хл a (П680) | ? | ? | |
ФС — фотосистема; бхл — бактериохлорофилл; хл — хлорофилл; б/феоф — бактериофеофитин; феоф — феофитин; П — фотохимически активные формы хлорофилла с указанием длины волны, при которой происходит индуцированное светом изменение поглощения пигмента; Х — хинон; УХ — убихинон; MX — менахинон; ПХ — пластохинон; FeS — железосероцентры; ? — информация отсутствует.
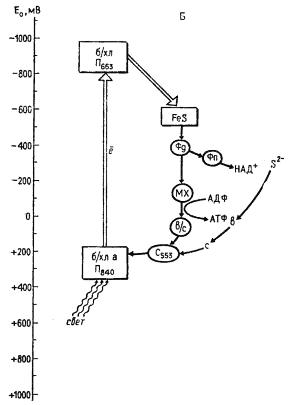
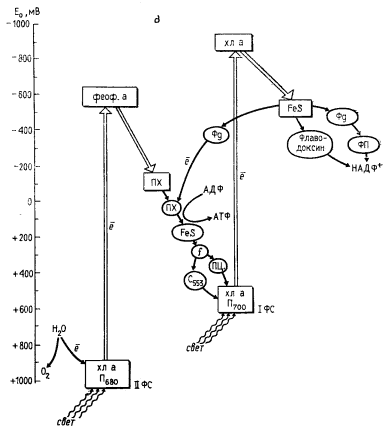
|
| Рис. 75. Организация фотосинтетического аппарата разных групп эубактерий: А — пурпурные бактерии; Б — зеленые серобактерии; В — цианобактерии. Хл — хлорофилл; б/хл — бактериохлорофилл; феоф — феофитин; б/феоф — бактериофитин; ФС — фотосистема; FeS — железосеросодержащий белок; Фд — ферредоксин; Фп — флавопротеин; ПХ — пластохинон; MX — менахинон; УХ — убихинон; ПЦ — пластоцианин; b, с, f — цитохромы. Прямоугольниками обведены компоненты реакционного центра, овалом — компоненты электронного транспорта, связанные с мембраной. Двойной стрелкой обозначены перемещения электрона в реакционном центре |
Что происходит после того, как вторичный акцептор захватывает электрон? В фотосинтетической мембране в непосредственной близости от реакционного центра локализованы определенным образом ориентированные переносчики электронов, и по этим переносчикам электрон может возвращаться на "свое" место в молекуле хлорофилла. Последним переносчиком, с которого электроны поступают на хлорофилл реакционного центра, у фотосинтезирующих организмов в большинстве случаев служат цитохромы типа с. Возвращение электрона — темновой процесс. Электрон перемещается по цепи переносчиков в соответствии с электрохимическим градиентом. Имеет место циклический транспорт электронов.
Циклическим электронным транспортом у фотосинтезирующих эубактерий не исчерпываются все возможные пути переноса электронов. Электрон, "оторванный" от первичного донора реакционного центра, может по цепи, состоящей из других переносчиков, не возвращаться к молекуле хлорофилла, а передаваться на такие клеточные метаболиты, как НАД(Ф)+ или окисленный ферредоксин, которые используются в реакциях, требующих восстановителя. Таким образом, электрон, покинувший молекулу хлорофилла, выводится из "системы". Возникает однонаправленный незамкнутый электронный поток, получивший название нециклического пути переноса электронов. У пурпурных и зеленых нитчатых бактерий функционирует только циклический светозависимый поток электронов. У остальных групп эубактерий фотоиндуцируется как циклический, так и нециклический перенос электронов, при этом у зеленых серобактерий и гелиобактерий оба пути электронного транспорта связаны с функционированием одной фотосистемы, а у цианобактерий и прохлорофит циклический перенос электронов зависит от активности I фотосистемы, а для нециклического потока электронов необходимо функционирование обеих фотосистем. Поток электронов по цепи переносчиков на определенных этапах сопряжен с направленным перемещением протонов через мембрану, что приводит к созданию протонного градиента, используемого для синтеза АТФ.
Фосфорилирование, сопряженное с циклическим потоком электронов, получило название циклического фотофосфорилирования. Соответственно, нециклическим фотофосфорилированием называют синтез АТФ, сопряженный с нециклическим электронным транспортом.
ОБРАЗОВАНИЕ ВОССТАНОВИТЕЛЯ ПРИ ФОТОСИНТЕЗЕ
Для протекания процессов биосинтетической природы необходима не только энергия в форме АТФ, но и восстановитель.
Особенно четко потребность в восстановителе проявляется, если основным или единственным источником углерода для конструктивных процессов служит CO2 — предельно окисленное углеродное соединение. Для превращения углекислоты в структурные компоненты клетки и клеточные метаболиты необходимо ее восстановление до уровня углеводов, белков, липидов. Это же справедливо и при использовании в качестве источника углерода органических соединений, более окисленных, чем вещества тела, например ацетата.
При циклическом электронном транспорте восстановитель как конечный продукт фотоиндуцированного процесса не образуется, поскольку электрон, покинувший молекулу хлорофилла, в конечном итоге вновь возвращается к ней. Образование восстановителя возможно только на путях нециклического переноса электронов.
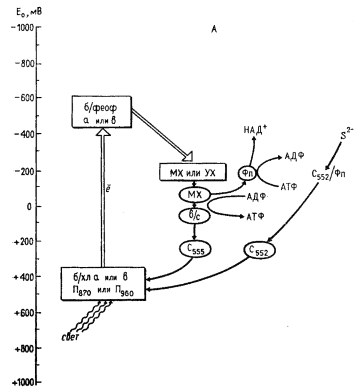
Отсутствие у пурпурных и зеленых нитчатых бактерий светозависимого восстановления НАД+ или ферредоксина связано с тем, что электроны, отрывающиеся от молекулы хлорофилла, в результате фотохимической реакции акцептируются на хиноновых соединениях, окислительно-восстановительный потенциал которых недостаточно отрицателен для непосредственного восстановления НАД+ или ферредоксина (см. табл. 11). В этих группах фотосинтезирующих эубактерий восстановитель образуется в результате темнового переноса электронов от экзогенных доноров (сульфид, тиосульфат, органические соединения) против электрохимического градиента — обратного переноса электронов (рис. 75, А). Последний осуществляется с участием электронтранспортной цепи, в состав которой входят флавопротеины, за счет энергии, генерируемой в процессе циклического электронного транспорта.
У зеленых серобактерий и гелиобактерий в реакционных центрах под действием поглощенного кванта света "подъем" электронов осуществляется до уровня порядка — 500 мВ, что делает возможным прямое восстановление НАД+ или ферредоксина путем переноса электронов со вторичного акцептора на эти соединения, т. е. восстановитель образуется в фотохимической реакции. Таким образом, в этих группах фотосинтезирующих эубактерий в результате фотохимической реакции одного типа индуцируется как циклический транспорт электронов, приводящий к образованию АТФ, так и нециклический, при котором возникает восстановитель (рис. 75, Б).
У цианобактерий и прохлорофит в результате двух фотохимических реакций электроны поднимаются до уровня приблизительно — 500 мВ, что делает возможным их прямой перенос на молекулы ферредоксина и НАДФ+ (рис. 75, В). В группах эубактерий, осуществляющих кислородный фотосинтез, фотоиндуцируются два потока электронов: циклический и нециклический. Циклический перенос электронов, связанный с активностью I фотосистемы, приводит к получению только энергии. При нециклическом электронном транспорте, обеспечиваемом активностью двух последовательно функционирующих фотохимических реакций, на конечном этапе электронного переноса образуется восстановитель, а на отрезке электронтранспортной цепи между двумя фотосистемами, где электроны переносятся по электрохимическому градиенту, имеет место запасание энергии в молекулах АТФ.
ЭКЗОГЕННЫЕ ДОНОРЫ ЭЛЕКТРОНОВ В БЕСКИСЛОРОДНОМ ФОТОСИНТЕЗЕ
Нециклический транспорт электронов приводит к тому, что электрон, "оторвавшийся" от молекулы хлорофилла, не возвращается к ней, а переходит на другие переносчики, с которых потом используется в системе реакций восстановительной природы. В результате в молекуле хлорофилла возникает электронная "вакансия", которую необходимо заполнить, чтобы молекула пигмента могла функционировать. Для этой цели сформировался поток электронов, донорами которых являются легко окисляемые экзогенные вещества.
В качестве веществ — экзогенных доноров электронов — используются как органические, так и неорганические соединения. В последнем случае это в основном различные восстановленные соединения серы (H2S, сульфит, молекулярная сера, тиосульфат, тетратионат, тиогликолят), а также молекулярный водород.
Что представляют собой сформировавшиеся у эубактерий, осуществляющих бескислородный фотосинтез, пути переноса электронов от экзогенных доноров? Окислительно-восстановительные потенциалы органических и неорганических соединений, используемых в качестве экзогенных доноров электронов, таковы, что эти соединения не могут осуществлять темновое восстановление НАД+. В то же время они достаточно отрицательны, чтобы обеспечить донирование электронов на молекулы бактериохлорофилла реакционного центра55.
55 Исключение составляет молекулярный водород, окислительно-восстановительный потенциал которого ( — 420 мВ) достаточен для темнового восстановления НАД+.
У пурпурных и зеленых нитчатых бактерий, у которых функционирует только светозависимый циклический электронный транспорт, нет надобности в заполнении электронной "вакансии" в молекуле хлорофилла. В то же время проблема получения фотохимическим путем восстановителя не решена.
Конкретные пути, ведущие к получению восстановленного НАД или ферредоксина, зависят от окислительно-восстановительного потенциала экзогенных доноров электронов. При окислении сукцината, например, электроны прямо поступают на хиноновые соединения и от них с помощью энергозависимого обратного электронного транспорта на НАД+ и ферредоксин. При окислении восстановленных соединений серы, потенциал которых недостаточно отрицателен для восстановления хинонов, электроны поступают на них не прямо, а через реакционные центры (см. рис. 75, А). В их переносе до реакционного центра участвуют растворимые и связанные с мембраной флавопротеины и цитохромы.
Функционирование фотохимического пути образования восстановителя у зеленых серобактерий и гелиобактерий ставит их перед проблемой заполнения возникающих электронных "вакансий" в молекулах бактериохлорофилла реакционного центра. Это достигается путем переноса электронов по электрохимическому градиенту от экзогенного донора к молекулам пигмента. В переносе участвуют растворимые и связанные с мембраной цитохромы типа b и с (см. рис. 75, Б). Таким образом, на определенном этапе эволюции эубактерий сформировался способ получения энергии, в основе которого лежит использование энергии света, и для функционирования этого пути необходимы определенные экзогенные вещества.
Можно только предполагать, как складывались механизмы для более эффективного использования этого вида энергии. На первых этапах, когда в окружающей среде содержалось достаточное количество восстановленных органических соединений, свет, вероятно, использовался в качестве дополнительного к субстратному фосфорилированию источника энергии. Чтобы осуществить эту функцию, необходимо трансформировать энергию света в химическую энергию в форме АТФ. Для этого достаточно было сформирования фотоиндуцированного циклического электронного транспорта, приводящего только к синтезу АТФ. Потребность в восстановителе обеспечивалась за счет органических соединений, содержавшихся во внешней среде.
Постепенное уменьшение содержания в среде восстановленных органических субстратов привело существовавшие тогда фототрофные организмы к необходимости расширить круг используемых источников углерода. Они приобрели способность усваивать в качестве такого источника углекислоту. Возникновение этой способности остро поставило вопрос об источнике электронов, необходимых для восстановления углекислоты до уровня восстановленности углеродсодержащих соединений клетки. Световая энергия стала использоваться не только для получения АТФ, но и для образования восстановителя, т. е. сформировался нециклический путь переноса электронов. Отток электронов на конструктивные процессы необходимо было компенсировать притоком электронов, способных заполнить электронную "вакансию" в молекуле хлорофилла.
Происходил постоянный поиск в окружающей среде соединений, которые могли бы выполнять функцию экзогенных доноров электронов. Определенным шагом вперед была большая независимость от органических соединений внешней среды, выразившаяся в способности использовать в качестве экзогенных доноров электронов восстановленные соединения серы.
ВОЗНИКНОВЕНИЕ ВТОРОЙ ФОТОСИСТЕМЫ
Выбор в качестве экзогенных доноров электронов восстановленных соединений серы обусловил определенную привязанность возникших фототрофных эубактерий к местам обитания, где эти соединения имеются. Колоссальное преимущество форм, которые сохранив положительные моменты сформированного фотосинтетического аппарата, могли бы в качестве экзогенного донора электронов использовать повсеместно распространенное вещество, очевидно. Таким веществом является вода. Поэтому следующий принципиально важный шаг на пути эволюции фотосинтеза и фотосинтезирующих организмов — способность использовать воду в качестве донора электронов.
Однако окислительно-восстановительный потенциал системы вода — молекулярный кислород равен+ 820 мВ, из чего следует, что электронная "вакансия", возникающая, например, в молекуле бактериохлорофилла реакционного центра зеленых серобактерий при нециклическом транспорте электронов, не может быть заполнена электроном воды (фотоокисленная форма бактериохлорофилла реакционного центра зеленых серобактерий — пигмента П840 — имеет окислительно- восстановительный потенциал порядка +250 мВ). Чтобы использование электронов воды стало возможным, необходимо, во- первых, их "оторвать" от молекулы H2O, термодинамически очень невыгодного донора электронов, и, во- вторых, "поднять" на более высокий энергетический уровень, позволяющий включаться в фотосистему, описанную выше. Природа решила эти проблемы путем создания дополнительной пигментной системы, обозначаемой как фотосистема II.
Известны две группы эубактерий, у которых фотосистема II уже сформировалась, и процесс фотосинтеза функционирует на качественно ином уровне. Это цианобактерии и прохлорофиты. Формирование II фотосистемы у них связано с появлением новых фоторецепторов и образованием новых типов фотохимических реакционных центров. Возник новый вид хлорофилла — хлорофилл а, функционирующий как светособирающий пигмент и в модифицированных формах входящий в состав реакционных центров: II фотосистемы — П680, I фотосистемы — П700. Возникли и новые пигменты антенны: фикобилипротеины и хлорофилл b.
Обнаружено, что в фотоокисленном состоянии хлорофилл a реакционного центра II фотосистемы имеет окислительно-восстановительный потенциал порядка +1000...+1300 мВ, т. е. настолько положительный, что может быть восстановлен за счет электронов воды. Механизм реакций, связанных с переносом электронов от молекул воды на П680, неизвестен. Установлено, что необходимым компонентом системы разложения воды является марганец. Очевидно также, что путь электронов от воды до П680 включает больше, чем один этап. Таким образом, фотосистема II была достроена к фотосистеме I для того, чтобы стало возможным использование воды в качестве донора электронов. Побочный продукт этого процесса — молекулярный кислород. Фотосинтез, осуществляемый при координированном функционировании двух фотосистем и сопровождающийся выделением O2 из воды, стал одним из основных типов энергетического метаболизма у высших форм жизни и занимает доминирующее положение в энергетической системе живого мира.
Общая схема фотосинтеза цианобактерии представляет собой определенную серию реакций, включающую две последовательно действующие фотореакции (рис. 75, В). Свет, поглощаемый фоторецепторами II фотосистемы — фикобилипротеинами, хлорофиллом a, каротиноидами, — передается на хлорофилл реакционного центра. Поглощение кванта света этим пигментом приводит к отрыву от него электрона и акцептированию молекулой особой формы пластохинона. Окисленная молекула Лево восстанавливается за счет электронов воды, подвергающейся фотоокислению в реакционных центрах фотосистемы II:
Электрон от акцептора II фотосистемы проходит через цепь переносчиков и поступает в реакционный центр I фотосистемы, на фотоокисленную форму хлорофилла a — пигмент П700 (E0 ~+500 мВ), заполняя электронную "вакансию" аналогично тому, как это происходит при фотосинтезе зеленых серобактерий. Перенос электронов от акцептора электронов II фотосистемы до реакционного центра I фотосистемы — темновой процесс, состоящий из серии этапов, в которых участвуют переносчики с понижающимися восстановительными потенциалами, такие как цитохромы разного типа, пластоцианин (медьсодержащий белок), пластохинон. Электронный транспорт на этом участке на определенных этапах сопровождается ориентированным поперек мембраны переносом протонов и, следовательно, генерированием DmH+, разрядка которого с помощью протонной АТФ-синтазы приводит к синтезу АТФ.
Поглощение еще одного кванта света молекулой хлорофилла реакционного центра I фотосистемы (П700) приводит к отрыву от нее электрона, перемещающегося против электрохимического градиента, и акцептированию его молекулой FeS-белка, функционирующего у цианобактерии в качестве вторичного акцептора электронов I фотосистемы. От FeS-центра электрон проходит через цепь переносчиков (ферредоксин, флавопротеин) и акцептируется молекулой НАДФ+56. Восстановленные молекулы НАДФ далее используются как доноры электронов в различных биосинтетических процессах и в первую очередь для восстановления CO2.
56 У цианобактерии два этапа электронного транспорта могут осуществляться с помощью разных переносчиков: от цитохрома f до П700 с помощью пластоцианина или при недостатке меди с помощью цитохрома c553; от FeS до НАДФ+ с участием ферредоксина и флавопротеина или при недостатке железа в среде с участием специфического флавопротеина — флаводоксина.
Итогом двух фотохимических реакций является создание "ассимиляционной силы" — НАДФ-H2 и АТФ. Конечные продукты фотосинтеза в этом случае в принципе аналогичны продуктам, образующимся при бескислородном фотосинтезе, за исключением того, что в последнем случае восстановитель находится в форме НАД-H2.
I фотосистема цианобактерий и прохлорофит (как и эубактерий, имеющих только одну фотосистему) фотоиндуцирует также циклический перенос электронов (рис. 75, В), обеспечивающий клетку энергией. В циклическом потоке электроны, акцептированные FeS-белком, через цепь переносчиков вновь возвращаются к месту своего старта и заполняют электронную "вакансию" в молекуле П700. Циклический электронный транспорт сопровождается генерированием протонного градиента и синтезом АТФ.
Для восстановления 1 молекулы CO2 у фототрофов, имеющих две фотосистемы, необходима энергия 8 — 10 квантов поглощенного света. Эта величина складывается из следующих значений. Перенос одного электрона от воды на НАДФ+ требует 2 квантов света. Восстановление молекулы НАДФ+ происходит с использованием 2 электронов, т. е. 4 квантов света. Для ассимиляции 1 молекулы CO2 в восстановительном пентозо-фосфатном цикле необходимы 2 молекулы НАДФ-H2, т. е. 8 квантов света. Кроме восстановителя в процессе ассимиляции CO2 используется энергия в виде АТФ. В нециклическом электронном транспорте наряду с НАДФ-H2 при переносе 2 электронов синтезируются предположительно 2 — 3 молекулы АТФ. Ассимиляция 1 молекулы CO2 в восстановительном пентозофосфатном цикле требует 3 молекул АТФ.
Таким образом, нециклическая электронтранспортная система способна или целиком обеспечивать ассимиляцию CO2 в восстановительном пентозофосфатном цикле энергией, или для этого нужны дополнительные молекулы АТФ. Последние могут быть получены в циклическом процессе при затрате дополнительных квантов света.
Определение квантового расхода при восстановлении CO2 у эубактерий с одной фотосистемой обнаружило такую же величину. Поскольку у этих бактерий только одна фотосистема, для активирования электрона необходим 1 квант света. Поэтому восстановление молекулы НАД+ требует только 2 квантов света и, следовательно, общий квантовый расход для ассимиляции CO2 у эубактерий с одной фотосистемой должен быть значительно ниже, чем у организмов с двумя фотосистемами. Чтобы объяснить экспериментально полученные данные, высказываются следующие предположения. У пурпурных и зеленых нитчатых бактерий, у которых фотоиндуцируется только циклический транспорт электронов, квантовый расход отражает величину световой энергии, затрачиваемой на осуществление обратного транспорта электронов, приводящего к восстановлению НАД+, а также на ассимиляцию CO2. У зеленых серобактерий и гелио-бактерий фотоиндуцируемый нециклический перенос электронов (в отличие от фототрофов с двумя фотосистемами) не связан с получением клеточной энергии. Энергия вырабатывается только в процессе циклического переноса электронов, при этом система циклического фотофосфорилирования включает 2 генератора DmH+.
ПУТИ ИСПОЛЬЗОВАНИЯ СO2 ФОТОСИНТЕЗИРУЮЩИМИ ЭУБАКТЕРИЯМИ
Согласно распространенным представлениям наиболее древние формы жизни, источником энергии для которых служили реакции субстратного фосфорилирования, использовали органические соединения внешней среды одновременно по двум каналам: в качестве источника энергии и источника углерода. Постепенное исчерпание таких соединений из окружающей среды поставило организмы перед двумя проблемами: поиском новых источников энергии и новых источников углерода. В первом случае это привело к использованию энергии света, во втором — к использованию углекислоты.
Как предельно окисленное соединение CO2 не может служить источником энергии, эта же ее особенность делает углекислоту и "дорогостоящим" источником углерода. И только обеднение среды восстановленными углеродными соединениями на начальном этапе развития жизни поставило организмы перед необходимостью использовать углекислоту в качестве источника углерода ценой больших энергетических затрат, т. е. сформировать механизмы автотрофной фиксации CO2 и выработать способность синтезировать все углеродные соединения из углерода углекислоты. Однако было бы неверным считать, что до этого углекислота была инертным соединением и никак не вовлекалась в метаболизм анаэробных хемогетеротрофов. Наоборот, углекислота весьма активно использовалась в конструктивном и энергетическом метаболизме разных групп первично анаэробных хемогетеротрофов.
Все гетеротрофные организмы (низшие и высшие) с помощью определенных ферментативных реакций активно включают углекислоту в метаболизм, при этом у прокариот пути использования CO2 намного многообразнее, чем у эукариот57. Углекислота у прокариот активно используется по путям как конструктивного, так и энергетического метаболизма. В конструктивном метаболизме она выполняет две основные функции: присоединение углекислоты в качестве C1-группы к молекуле клеточного метаболита приводит к удлинению ее углеродного скелета; кроме того, при этом происходит регулирование общего уровня окисленности- восстановленности клеточных метаболитов, поскольку включение CO2-группы в молекулу приводит к заметному повышению степени ее окисленности. В этом случае CO2 входит в состав веществ клетки.
57 Предположение о том, что использование CO2 является, вероятно, общим свойством всех организмов, было высказано еще в 1908 г. А. Ф. Лебедевым. Впервые фиксацию CO2 наблюдали в 1936 г. у пропионовых бактерий X. Вуд и К. Веркман.
Свойство предельной окисленности молекулы CO2 используется в энергетическом метаболизме ряда анаэробных эубактерий, получающих энергию в процессе брожения, где CO2 служит для удаления избытка восстановителя, т. е. как конечный акцептор электронов. Эта же особенность молекулы CO2 находит применение и в энергетическом метаболизме некоторых анаэробных эубактерий (ацетогены) и архебактерий (метаногены), но у них электроны на CO2 поступают через цепь связанных с мембраной переносчиков электронного транспорта. CO2, участвующая в реакциях энергетического метаболизма, не включается в вещества клетки, а продукты ее восстановления (в виде молекул формиата, ацетата, метана) накапливаются в среде. В наибольшей степени способность вовлекать CO2 в метаболизм среди первично анаэробных хемогетеротрофных эубактерий проявляется в группе клостридиев.
Основным путем включения CO2 в вещества клетки у хемогетеротрофных прокариот служат реакции карбоксилирования. Обнаружено несколько десятков таких реакций, некоторые из них приведены в табл. 24.
Можно полагать, что к тому времени, когда возникла необходимость шире использовать CO2 как источник углерода для построения веществ клетки, уже были сформированы различные ферментативные реакции включения CO2 в хемогетеротрофный метаболизм. Обращает на себя внимание, что акцепторами углекислоты служили органические кислоты, используемые в большинстве случаев в активированной форме. Поэтому основа для перехода к более интенсивному использованию CO2 в конструктивном метаболизме, приведшая в конечном итоге к автотрофии, была заложена в недрах хемогетеротрофного метаболизма.
Некоторые анаэробные прокариоты, относящиеся к эу- и архебактериям, — хемоавтотрофы. Фиксация CO2 у них происходит по ацетил-КоА-пути, не замкнутому в цикл (см. рис. 62). Образующийся ацетил-КоА служит акцептором третьей молекулы CO2, что приводит к синтезу пировиноградной кислоты (см. табл. 24). Возможно, этот путь фиксации CO2 — первая примитивная форма автотрофии. Кажется вполне вероятным, что дальнейшие поиски путей автотрофного метаболизма проходили параллельно с формированием аппарата для использования энергии света, поскольку на первом этапе эволюции энергетические и конструктивные процессы зависели от одних и тех же источников и, следовательно, организмы одновременно были поставлены перед проблемой поиска новых источников энергии и углерода.
Таблица 24. Включение CO2 в клеточные метаболиты у хемогетеротрофов
| Фермент | Катализируемая реакция |
| Пируваткарбоксилаза | пировиноградная кислота + CO2 + АТФ ® ЩУК + АДФ +ФН |
| ФЕП-карбоксикиназа | ФЕП + CO2 + АДФ ® ЩУК + АТФ |
| ФЕП-карбоксилаза | ФЕП + CO2 ® ЩУК + ФН |
| ФЕП-карбокситрансфосфорилаза | ФЕП + CO2+ ФН ® ЩУК + ФФН |
| Малатдегидрогеназа | пировиноградная кислота + CO2 НАДФ-H2 ® яблочная кислота + HAДФ+ |
| Изоцитратдегидрогеназа | a-кетоглутаровая кислота + CO2 + НАД(Ф)-H2 ® изолимонная кислота + НАД(Ф)+ |
| Пируватсинтаза | ацетил-КоА + CO2 + Фдвосст ® пировиноградная кислота + Фдок + КоА-SH |
| a-Кетобутиратсинтаза | пропионил-КоА + CO2+ Фдвосст ® a-кетобутират + Фдок + КоА-SH |
| a-Кетоглутаратсинтаза | сукцинил-КоА + CO2 + Фдвосст ® a-кетоглутарат + Фдок + KoA-SH |
| Пропионил-КоА-карбоксилаза | пропионил-КоА + CO2 + АТФ ® метилмалонил-КоА + АДФ + ФН |
| Ацетил-КоА-карбоксилаза | ацетил-КоА + CO2 + АТФ ® малонил-КоА + АДФ + ФН |
Восстановительный цикл трикарбоновых кислот
У зеленых серобактерий обнаружен циклический механизм фиксации CO2, в основе которого лежат реакции восстановительного карбоксилирования органических кислот. Он получил. название восстановительного ЦТК, или цикла Арнона (рис. 76). В этом цикле углекислота фиксируется в четырех ферментативных реакциях, две из которых идут при участии фотохимически восстановленного ферредоксина, а одна — таким же путем образованного НАД-H2. В результате одного оборота цикла из 4 молекул CO2, 10 [Н] с использованием энергии (3 молекулы АТФ) синтезируется молекула ЩУК — конечный продукт цикла.
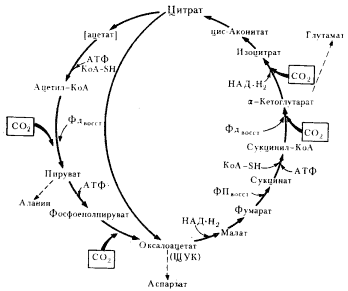
|
| Рис. 76. Восстановительный цикл трикарбоновых кислот. Объяснение см. в тексте (по Кондратьевой, 1981) |
Описан и более "короткий" вариант цикла, в результате которого фиксируются 2 молекулы CO2 с использованием для их восстановления 8 [Н] и энергии в форме АТФ. Конечным продуктом в этом случае является ацетат в виде ацетил-КоА, использующийся для построения веществ клетки.
Прежде всего обращает на себя внимание, что все реакции, в которых происходит фиксация CO2 в цикле, функционируют как механизмы хемогетеротрофной фиксации CO2 или аналогичны им (табл. 24). Таким образом, собственно реакции фиксации CO2 принципиально не новы, они заимствованы из гетеротрофного метаболизма. Шагом вперед можно считать создание определенной последовательности ферментативных реакций, замыкающихся в цикл.
Фиксация CO2 по механизму, обнаруженному Д. Арноном (D. Arnon) с сотрудниками, не получила широкого распространения среди фотосинтезирующих эубактерий. По этому пути CO2 фиксируется у зеленых серобактерий 58.
58 Восстановительный ЦТК, возможно, функционирует у водородной бактерии Hydrogenobacter thermophilus, некоторых сульфатвосстанавливающих эубактерий, архебактерии Sulfolobus brierlyi и гелиобактерий.
Восстановительный пентозофосфатный цикл
Восстановительный пентозофосфатный цикл, или цикл Кальвина, являющийся основным путем фиксации CO2 у всех высших фотосинтезирующих организмов, функционирует уже в группе пурпурных бактерий. У цианобактерий и прохлорофит это также основной путь фиксации CO2. Последовательность ферментативных реакций, приводящих к фиксации углекислоты и образованию из нее молекулы гексозы, была расшифрована М. Кальвином (М. Calvin) с сотрудниками в 50-х гг. (рис. 77). Что в этом цикле нового, существенно отличающего его от всех реакций фиксации CO2 как гетеротрофной природы, так и функционирующих в восстановительном ЦТК? Новая химическая природа акцептора. Акцепторами CO2 во всех до сих пор описанных реакциях были органические кислоты в обычной или активированной форме. В этом цикле впервые акцептором CO2 выступает вещество углеводной природы — активированная молекула пентозы.
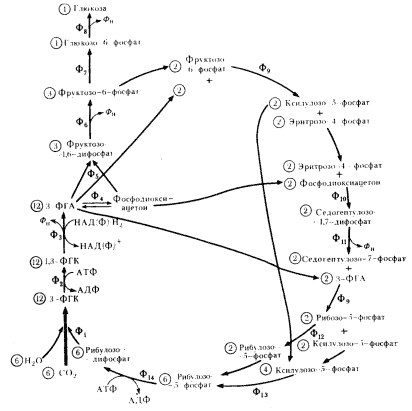
|
| Рис 77. Восстановительный пентозофосфатный цикл: Ф1 — рибулозодифосфаткарбоксилаза; Ф2 — 3-фосфоглицераткиназа; Ф3 — 3-ФГА-дегидрогеназа; Ф4 — триозофосфатизомераза; Ф5 — фруктозо-1,6-дифосфатальдолаза; Ф6 — 1,6-фосфофруктозофосфатаза; Ф7 — глюкозофосфатизомераза; Ф8 — глюкозо-6-фосфатаза; Ф9 — транскетолаза; Ф10 — альдолаза; Ф11 — дифосфатаза; Ф12 — фосфопентозоизомераза; Ф13 — фосфопентозоэпимераза; Ф14 — фосфорибулокиназа. Цифры, заключенные в кружок обозначают число молекул, участвующих в реакциях (по Dagley, Nicholson, 1973) |
Ферментативные пути, ведущие к синтезу пентозофосфатов, уже формировались в окислительном пентозофосфатном пути. Для восстановительного пентозофосфатного цикла уникальными являются два фермента, не участвующие в других метаболических путях: фосфорибулокиназа и рибулозодифосфаткарбоксилаза. Первый из них связан с активированием молекулы акцептора путем вторичного фосфорилирования, а второй катализирует реакцию акцептирования рибулозо-1,5-дифосфатом молекулы CO2 и последующее гидролитическое расщепление образовавшейся гексозы на 2 молекулы 3-ФГК, одна из которых в карбоксильной группе содержит углерод из CO2.
Образовавшиеся молекулы 3-ФГК затем подвергаются серии последовательных ферментативных превращений, ведущих к образованию молекулы глюкозы. Эти превращения включают реакции, известные в гликолитическом пути, но идущие теперь в обратном направлении (реакции, катализируемые ферментами Ф2 — Ф5 и Ф7 на рис. 77), и реакции, сформировавшиеся у гетеротрофов на пути синтеза глюкозы из C2- и C3- соединений для обхода необратимых реакций гликолитического пути (реакции, катализируемые ферментами Ф6 и Ф8 на рис. 77). Реакция восстановления 1,3-ФГК до 3-ФГА, катализируемая 3- ФГА-дегидрогеназой, у пурпурных и зеленых бактерий зависит от НАД-H2, а у цианобактерий и высших растений — от НАДФxH2.
Такова биосинтетическая часть цикла, ведущая к фиксации CO2 и образованию из нее молекулы гексозы. Однако чтобы функционировал этот механизм, необходимо постоянное воспроизведение молекул — акцепторов CO2. Остальные ферментативные реакции цикла служат для регенерации акцептора CO2 — рибулозо-1, 5-дифосфата и катализируются ферментами, большинство из которых функционирует в окислительном пентозофосфатном пути (ферменты Ф9 — Ф13 на рис. 77). Суммарное уравнение восстановительного пентозофосфатного цикла можно изобразить следующим образом:
Для синтеза 1 молекулы глюкозы из CO2 необходимо 6 оборотов цикла.
Таким образом, сформировавшийся для автотрофной ассимиляции CO2 механизм базируется на ферментативных реакциях, которые уже функционировали к тому времени у хемогетеротрофных прокариот. Для работы цикла необходимо было создать только две новые реакции, связанные с подготовкой акцептора и собственно акцептированием CO2.
Восстановительный пентозофосфатный цикл является основным механизмом автотрофной ассимиляции углекислоты. Последняя у большинства фотосинтезирующих эубактерий восстанавливается с помощью фотохимически образованной "ассимиляционной силы" — АТФ и восстановителя. Однако и АТФ, и восстановитель (НАДФ-H2 или НАД-H2) образуются в разных метаболических путях. Поэтому нельзя рассматривать восстановительный пентозофосфатный цикл ассимиляции CO2 строго привязанным только к фотосинтезу. У большой группы хемоавтотрофных эубактерий этот путь фиксации CO2 сочетается с темновыми окислительными процессами получения энергии. Важно отметить только, что это основной путь ассимиляции CO2, если последняя служит единственным или главным источником углерода.
Таким образом, обнаруженные у фотосинтезирующих эубактерий типы фотосинтеза различаются организацией фотосинтетического аппарата, природой экзогенных доноров электрона и выделяемыми окисленными продуктами. Общим для всех типов фотосинтеза является способность превращать энергию света в доступные клетке формы энергии, которая потребляется затем во всех энергозависимых процессах, в том числе и для биосинтезов. Использование ее для ассимиляции CO2 — только один из вариантов обеспечения энергией конструктивного метаболизма у фототрофных эубактерий.
ГРУППЫ ФОТОСИНТЕЗИРУЮЩИХ ЭУБАКТЕРИИ
Известно 5 групп эубактерий, способных преобразовывать световую энергию в, химическую с помощью хлорофилла. Фотосинтез, осуществляемый ими, делится на 2 типа: не сопровождающийся выделением молекулярного кислорода (бескислородный фотосинтез) и сопровождающийся выделением O2 (кислородный фотосинтез). В соответствии с этим все фотосинтезирующие эубактерии в IX издании Определителя бактерий Берги предложено разделить на две таксономические группы в ранге классов: Anoxyphotobacteria и Oxyphotobacteria. Эубактерии, осуществляющие бескислородный фотосинтез, на основании таких признаков, как пигментный состав и тонкое строение фотосинтетического аппарата, делятся на 3 группы: пурпурные, зеленые бактерии и гелиобактерии. Эубактерии, фотосинтез которых сопровождается выделением O2, включают 2 группы организмов: цианобактерии и прохлорофиты. В основу деления положены те же признаки (см. табл. 21–23). Критерии, определяющие там, где это возможно, деление на таксоны более низкого ранга, даны при характеристике каждой из выделенных групп.
Пурпурные бактерии
Группа пурпурных бактерий, насчитывающая более 50 видов, представлена одноклеточными организмами разной морфологии (рис. 78). Длина их колеблется от 1 до 20 мкм, ширина — от 0,3 до 6 мкм. Некоторые виды образуют выросты. Среди пурпурных бактерий есть неподвижные и подвижные формы.
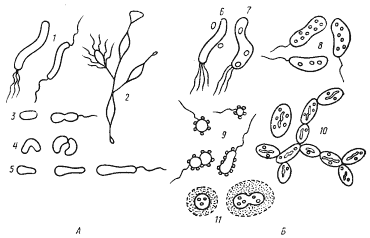
|
| Рис. 78. Основные морфологические типы пурпурных бактерий: А — несерные пурпурные бактерии: 1 — Rhodospirillum; 2 — Rhodomicrobium; 3 — Rhodobacter sphaeroides; 4 — Rhodocyclus; 5 — Rhodopseudomonas palustris; Б — пурпурные серобактерии: 6 — Ectothiorhodospira; 7 — Thiospirillum; 8 — Chromatium; 9 — Thiocystis; 10 — Thiodictyon; 11 — Thiocapsa (по Горленко, Дубининой, Кузнецову, 1977) |
Движение осуществляется с помощью одного или пучка жгутиков, расположенных обычно полярно. Большинство пурпурных бактерий размножаются бинарным делением, некоторые виды — почкованием. Клетки неподвижных форм, размножающихся поперечным делением в разных плоскостях, имеют тенденцию формировать агрегаты правильной геометрической формы.
Все пурпурные бактерии окрашиваются отрицательно по Граму и, следовательно, имеют сложное строение клеточной стенки. Для клеток характерна хорошо развитая система внутрицитоплазматических фотосинтетических мембран, являющихся производными ЦПМ и сохранивших с ней отчетливо наблюдаемую связь. Мембраны имеют вид отдельных пузырьков, трубок или пластинок (ламелл), располагающихся по периферии клетки (см. рис. 4), и представляют вместе с ЦПМ единую систему. Подобно многим обитающим в толще воды эубактериям в клетках некоторых неподвижных пурпурных бактерий содержатся газовые вакуоли. В качестве запасных веществ обнаружены углевод типа гликогена и поли-b-оксимасляная кислота. Группа пурпурных бактерий довольно гетерогенна в отношении нуклеотидного состава ДНК. Молярное содержание ГЦ-оснований колеблется от 45 до 73%, хотя у большинства представителей оно находится в пределах 61 — 73%.
Все пурпурные бактерии характеризуются сходным строением и функционированием фотосинтетического аппарата. Они могут расти на свету в анаэробных условиях, осуществляя фотосинтез бескислородного типа. Однако по целому ряду физиологических особенностей, в том числе и по использованию разных соединений в качестве донора электронов при фотосинтезе, между представителями пурпурных бактерий обнаружены значительные различия. Поэтому на основании ряда физиологических признаков группу подразделяют на пурпурные серные и несерные бактерии.
Для пурпурных серобактерий основной способ существования — фотолитоавтотрофия. Все представители этой группы могут расти при освещении в анаэробных условиях на среде с CO2 в качестве единственного источника углерода, используя как донор электронов сульфид (H2S). Многие виды могут использовать для этой цели молекулярную серу (S0), сульфит (SO32 – ), тиосульфат (S2O32–), молекулярный водород. Сульфид окисляется последовательно до молекулярной серы или сульфата, при этом глобулы серы откладываются в периплазматическом пространстве и впячиваниях (инвагинатах) ЦПМ, которые также являются частью этого пространства. Исключение составляют виды рода Ectothiorhodospira, окисляющие сульфид и тиосульфат до молекулярной серы, но не накапливающие последнюю в пределах клетки. Представители этого рода выделяют серу в среду, а затем поглощают ее и окисляют до SO42 –. Ферменты, катализирующие окисление восстановленных соединений серы, локализованы в периплазматическом пространстве и на наружной поверхности ЦПМ.
Пурпурные серобактерии обнаруживают весьма ограниченную способность использовать органические соединения. В большинстве случаев последние служат дополнительными источниками углерода и редко — донорами электронов. Все виды могут фотометаболизировать ацетат и пируват, только некоторые способны существовать полностью фотоорганогетеротрофно.
В течение длительного времени пурпурные серобактерии считали строгими анаэробами и облигатными фототрофами. Недавно было показано, что спектр отношения к молекулярному кислороду в этой группе достаточно широк. В большинстве пурпурные серобактерии высоко чувствительны к O2, однако и среди них есть виды, растущие в темноте в аэробных условиях на минеральной среде или с использованием органических соединений. Хемолитоавтотрофный рост при низком содержании O2 обнаружен у ряда пурпурных серобактерий, ассимилирующих CO2 в восстановительном пентозофосфатном цикле, а энергию получающих в процессе дыхания в результате окисления сульфида, тиосульфата, молекулярной серы или H2. Для некоторых представителей родов Ectothiorhodospira и Thiocapsa показан аэробный хемоорганогетеротрофный рост. Органические вещества в этом случае используются как источники углерода и энергии. Последняя запасается в процессе дыхания. Некоторые пурпурные серобактерии оказались также способными расти в темноте в анаэробных условиях (в атмосфере аргона или молекулярного водорода), сбраживая некоторые сахара или органические кислоты.
Пурпурные несерные бактерии имеют склонность к фотоорганогетеротрофному образу жизни, предпочитая в качестве доноров электронов и источников углерода в процессе фотосинтеза простые органические соединения: жирные кислоты, спирты, сахара, аминокислоты. Многие виды способны расти фотолитоавтотрофно, используя молекулярный водород в качестве донора электронов для восстановления CO2.
Некоторые типичные несерные пурпурные бактерии растут при освещении на минеральной среде, используя в качестве донора электронов H2S, тиосульфат или молекулярную серу. В большинстве случаев сульфид окисляется только до молекулярной серы, никогда не откладывающейся в клетке, но в отдельных случаях возможно последующее окисление S0 до сульфата.
В группе несерных бактерий обнаружено большое разнообразие метаболических путей, связанных с получением энергии. Многие представители этой группы способны расти в темноте в микроаэробных или аэробных условиях, получая энергию в процессе дыхания. У них активно функционирует замкнутый ЦТК, гликолитический путь и другие пути катаболизма органических соединений.
Представители рода Rhodobacter способны к хемоавтотрофии. Они растут на минеральной среде в темноте при пониженной концентрации O2, используя энергию, получаемую при окислении молекулярного водорода, для ассимиляции CO2.
У несерных пурпурных бактерий развиты контакты с молекулярным кислородом. У них имеются ферментные системы защиты от O2. Все несерные пурпурные бактерии способны расти хемотрофно в микроаэробных условиях, хотя не все из них могут переносить атмосферное содержание O2. При концентрации O2 от 0,5 до 5% фотосинтез и окислительный метаболизм могут функционировать одновременно. Молекулярный кислород у несерных пурпурных бактерий (как и у всех эубактерий, осуществляющих бескислородный фотосинтез) выступает как мощный фактор, регулирующий их метаболизм. Уже в достаточно низких концентрациях O2 ингибируют синтез бактериохлорофиллов, внутрицитоплазматических мембран и рибулозодифосфаткарбоксилазы. В то же время в присутствии O2 наблюдается увеличение активности ферментов ЦТК.
Среди представителей рода Rhodobacter обнаружена способность расти в анаэробных условиях за счет окисления органических соединений, сопряженного с транспортом электронов на нитраты (анаэробное дыхание). Наконец, в последние годы для ряда несерных пурпурных бактерий показана способность расти анаэробно в темноте, осуществляя сбраживание органических субстратов, таких как сахара, пируват.
Таким образом, в этой группе обнаружены разные биосинтетические способности, сочетающиеся с разнообразными способами получения энергии. Источниками углерода могут быть CO2 или органические соединения, а источниками энергии — фотосинтез, аэробное и анаэробное дыхание, брожение.
Основные физиолого-биохимические различия между серными и несерными пурпурными бактериями представлены в табл. 25. До настоящего времени не найдено четкого признака или нескольких признаков, которые могли бы быть положены в основу деления пурпурных бактерий на рассмотренные физиологические группы. Как правило, признак, характерный для организмов одной группы, можно найти у представителей другой. Тем не менее можно выявить совокупность свойств, типичных либо для серных, либо для несерных пурпурных бактерий.
Недавно обнаружены эубактерий, выделенные в новый род Erythrobacter, образующие подобно многим пурпурным бактериям бактериохлорофилл a, но растущие только в аэробных условиях. Это грамотрицательные палочки, перемещающиеся с помощью жгутиков; размножаются бинарным делением. Молярное содержание ГЦ-оснований в ДНК — 60 — 64%. Система внутрицитоплазматических мембран везикулярного типа сходна с таковой несерных пурпурных бактерий. Помимо бактериохлорофилла a эритробактеры содержат в значительном количестве каротиноиды, определяющие их розовую или оранжевую окраску.
Таблица 25. Основные физиолого-биохимические различия между серными и несерными пурпурными бактериями
| Признак | Пурпурные бактерии | |
| несерные | серные | |
| Доноры электронов при фотосинтезе | ||
| H2S |
|
|
| S0 |
|
|
| H2 |
|
|
| Источник углерода | ||
| CO2 |
|
|
| Органические соединения |
|
|
| Рост в темноте на органических средах за счет | ||
| аэробного дыхания |
|
|
| анаэробного дыхания |
|
|
| брожения |
|
|
| Способность к хемоавтотрофии |
|
|
| Отношение к O2 воздуха | факультативные анаэробы | в большинстве — строгие анаэробы; отдельные виды — факультативные анаэробы |
| Способность к азотфиксации |
|
|
* Признак обнаружен у всех
(
![]() ),
большинства (
),
большинства (
![]() ),
некоторых (
),
некоторых (
![]() )
представителей группы;
(
)
представителей группы;
(
![]() )
признак отсутствует.
)
признак отсутствует.
** Количество фотоассимилируемых органических соединений и степень их использования невелики.
В отличие от пурпурных бактерий выделенные до сих пор представители рода Erythrobacter — облигатно аэробные хемоорганогетеротрофы: не могут расти анаэробно ни на свету59, ни в темноте; не растут на свету в аэробных условиях за счет неорганических субстратов, но хорошо растут в тех же условиях в присутствии разнообразных органических соединений (сахаров, органических кислот, некоторых одноуглеродных соединений). Многие штаммы нуждаются в витаминах.
59 Описан штамм Erythrobacter, способный расти на свету в анаэробных условиях, если молекулярный кислород заменить нитратами в качестве конечного акцептора электронов.
В то же время получены экспериментальные доказательства использования эритробактерами энергии света: установлено обратимое фотоокисление бактериохлорофилла a реакционного центра, показано светозависимое включение CO2 и повышение уровня АТФ в клетке; установлена способность мембранных препаратов к фотофосфорилированию. Однако фотосинтетический аппарат, имеющийся в клетках Erythrobacter, не может обеспечить их рост. Облигатная зависимость от молекулярного кислорода связана с тем, что для эритробактеров основным источником энергии служит O2-зависимое дыхание. Фотосинтетическая активность может иметь значение для поддержания жизнеспособности клеток в отсутствие в среде субстратов, обеспечивающих рост.
Бактерии рода Erythrobacter интересны тем, что необходимую для роста энергию получают в результате аэробного дыхания, но не утратили при этом бактериохлорофилла a и других компонентов фотосинтетического аппарата.
Зеленые бактерии
В течение длительного времени зеленые бактерии принимали за зеленые или сине-зеленые водоросли (цианобактерии). Начало их изучения как бактерий связано с именами C. Н. Виноградского и К. ван Ниля. Эта небольшая группа эубактерий, осуществляющих фотосинтез бескислородного типа, разделена на две подгруппы. Зеленые серобактерии — строгие анаэробы и облигатные фототрофы, способные расти на среде с H2S или молекулярной серой в качестве единственного донора электронов; при окислении сульфида до молекулярной серы последняя всегда откладывается вне клетки.
В другую подгруппу выделены нитчатые, передвигающиеся скольжением формы, факультативные анаэробы, предпочитающие использовать органические соединения при фототрофном метаболизме.
Почти все зеленые серобактерии — грамотрицательные одноклеточные неподвижные формы (рис. 79, А). Клетки палочковидные, яйцеобразные или слегка изогнутые. При выращивании в чистой культуре часто образуют цепочки, клубки или сетчатые структуры. Размножаются бинарным делением. В качестве запасного вещества накапливают гликогеноподобный полисахарид. Группа достаточно однородна по нуклеотидному составу ДНК: молярное содержание ГЦ-оснований колеблется от 48 до 58%.
Зеленые нитчатые бактерии состоят из множества палочковидных клеток (рис. 79, Б), размеры которых зависят от вида (0,5 — 5,5x2 — 6 мкм). Длина трихомов достигает 100 — 300 мкм. У некоторых видов трихомы окружены слизистым чехлом. Все описанные представители этой подгруппы имеют типичную грамотрицательную клеточную стенку, но не ригидную, а гибкую, обеспечивающую скользящее движение. Клетки внутри трихома размножаются поперечным бинарным делением. Кроме того, как и все нитчатые формы, зеленые скользящие бактерии размножаются путем отделения небольшой части трихома. Первая зеленая нитчатая бактерия Chloroflexus aurantiacus была выделена из термального серного источника. Позднее были выделены мезофильные варианты этого вида.
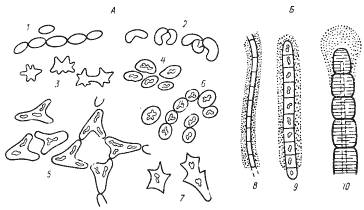
|
| Рис. 79. Основные морфологические формы зеленых бактерий:А — зеленые серобактерии: 1 — Chlorobium limicola; 2 — Chlorobium vibrioforme; 3 — Prosfhecochloris aestuarii; 4 — Pelodictyon lutecium; 5 — Pelodictyon clathratiforme; 6 — Clathrochloris sulfurica; 7 — Ancalochloris perfilievii; Б — зеленые скользящие бактерии: 8 — Chloroflexus aurantiacus; 9 — Chloronema giganteum; 10 — Oscillochloris chrysea (по Горленко, Дубининой, Кузнецову, 1977) |
Все зеленые серобактерии — облигатные фотолитоавтотрофы и строгие анаэробы (гораздо более строгие, чем пурпурные серобактерии). В присутствии O2 они не растут. Основной источник углерода — углекислота. Как доноры электронов могут использовать только неорганические соединения: H2S, S0, Na2S2O3, H2. Окисление сульфида, происходящее в периплазматическом пространстве, на первом этапе приводит к образованию молекулярной серы, откладывающейся вне клетки. После исчерпания H2S из среды S0 поглощается клетками и в периплазматическом пространстве происходит ее последующее окисление до сульфата. Изучение локализации процесса образования молекулярной серы у разных групп фототрофных и хемотрофных H2S-окисляющих эубактерий привело к заключению о его однотипности. Во всех случаях сера образуется в клеточном периплазматическом пространстве, но у одних организмов она потом выделяется в среду, у других остается в пределах клетки.
Способность использования зелеными серобактериями органических соединений ограничена несколькими сахарами, аминокислотами и органическими кислотами. Добавление этих соединений в среду приводит к некоторому стимулированию роста культуры и сводится к тому, что они в ограниченной степени используются как дополнительные источники углерода. Ни в одном случае органические соединения не могли служить донорами электронов или основным источником углерода. Их использование возможно только при наличии в среде H2S и CO2. Включение органических соединений в метаболизм зеленых серобактерий происходит по путям, сходным для большинства эубактерий. Определенная роль отводится обнаруженному в этой группе организмов "разорванному" ЦТК, функционирующему в системе конструктивного метаболизма. Для большинства зеленых серобактерий показана способность к фиксации N2.
Физиолого-биохимическая характеристика зеленых нитчатых бактерий основана главным образом на данных, полученных для разных штаммов Chloroflexus aurantiacus, обнаруживших значительное метаболическое разнообразие. C. aurantiacus может быть охарактеризован как факультативный анаэроб и фототроф. На свету он растет в аэробных и анаэробных условиях в присутствии разнообразных органических соединений: сахаров, спиртов, органических кислот и аминокислот. Некоторые штаммы этого вида способны к анаэробному фотоавтотрофному росту, используя H2 или H2S в качестве донора электронов. Окисление H2S приводит к образованию молекулярной серы и отложению ее в среде в виде аморфной массы. Молекулярная сера в очень незначительной степени затем окисляется до сульфата. Хемогетеротрофный рост также возможен в аэробных и для отдельных штаммов в анаэробных условиях.
В разных условиях роста в клетках C. aurantiacus обнаружены ферменты гликолитического пути, ЦТК и глиоксилатного шунта. В то же время у C. aurantiacus не найдено ни восстановительного ЦТК, ни восстановительного пентозофосфатного цикла и механизм, по которому осуществляется автотрофная фиксация CO2, пока не ясен. Показана активность разных реакций карбоксилирования, ведущих к синтезу ЩУК.
Хотя Chloroflexus растет в присутствии молекулярного кислорода, последний репрессирует синтез бактериохлорофиллов и образование хлоросом. В природных условиях популяции этих бактерий часто имеют оранжевый цвет из-за высокого содержания каротиноидов и низкого содержания бактериохлорофиллов в клетке. Поэтому первоначально Chloroflexus принимали за гетеротрофный организм. Только в фотолитоавтотрофных условиях при высоком содержании сульфида в среде и низких интенсивностях света лабораторные культуры или природные популяции Chloroflexus имеют зеленый цвет, обусловленный высоким содержанием бактериохлорофилла c. Данные, сравнивающие по некоторым признакам обе подгруппы зеленых бактерий, суммированы в табл. 26.
Таблица 26. Основные физиолого-биохимические различия между зелеными нитчатыми и серными бактериями
| Признак | Зеленые бактерии | |
| серные | нитчатые* | |
| Организация | одноклеточная | многоклеточная |
| Подвижность | неподвижные, за исключением представителей рода Chloroherpeton | подвижные (скольжение) |
| Газовые вакуоли |
|
|
| Запасное вещество | гликогеноподобный полисахарид | поли-b-оксимасляная кислота |
| Молярное содержание ГЦ-оснований в ДНК, % | 48–58 | 53–55 |
| Отношение к температуре | мезофилы | мезофилы и термофилы |
| Доноры электронов при фотосинтезе | H2S, S0, Na2S2O3, H2 | H2S, H2, органические соединения |
| Механизм ассимиляции CO2 при фотосинтезе | восстановительный ЦТК | не известен |
| Источники углерода | CO2, органические соединения | органические соединения, CO2 |
| Рост в темноте на органических средах за счет: | ||
| аэробного дыхания |
|
|
| анаэробного дыхания |
|
|
| брожения |
|
? |
| Цикл трикарбоновых кислот | "разорван" | "замкнут" |
| Способность к хемоавтотрофии |
|
|
| Отношение к O2 | облигатные анаэробы | факультативные анаэробы |
| Способность к азотфиксации |
|
? |
* Физиолого-биохимические свойства изучены в основном у разных штаммов Chloroflexus aurantiacus.
** ? — данных нет; остальные обозначения см. в табл. 25.
Гелиобактерии
Недавно обнаружены строго анаэробные фототрофные бактерии, содержащие единственный бактериохлорофилл g, отсутствующий в других группах фотосинтезирующих эубактерий с бескислородным типом фотосинтеза. Описаны два вида, различающиеся морфологически: Heliobacterium chlorum — одиночные длинные палочки (1x7–10 мкм), способные передвигаться скольжением, и Heliobacillus mobilis — короткие палочковидные формы с перитрихиально расположенными жгутиками. Клеточная стенка грамотрицательного типа, но по нуклеотидной последовательности 16S рРНК и составу пептидогликана обе описанные гелиобактерии близки к грамположительным эубактериям Bacillus subtilis.
В клетках помимо необычного бактериохлорофилла g обнаружено небольшое количество каротиноидов. Пигменты локализованы в ЦПМ, развитой системы внутрицитоплазматических мембран и хлоросом нет. Способ существования — облигатная фототрофия. Рост возможен только на свету в анаэробных условиях. Источниками углерода могут служить некоторые органические кислоты: уксусная, молочная, пировиноградная, масляная. Показана также возможность функционирования путей автотрофной фиксации CO2 (модифицированный и неполный восстановительный ЦТК). Описанные гелиобактерии проявляют очень высокую чувствительность к молекулярному кислороду. Дыхательный метаболизм отсутствует. Обнаруженные виды — активные азотфиксаторы.
Большой интерес к гелиобактериям связан с предположением, что они являются наиболее древними из существующих в настоящее время фотосинтезирующих эубактерий. Кроме того, на основании сходства между бактериохлорофиллом g и хлорофиллом с высказывается предположение о том, что гелиобактерии — предки пластид, содержащих хлорофилл c, имеющихся в группах бурых, диатомовых, золотистых и других водорослей.
Цианобактерии
К цианобактериям относится большая группа организмов, сочетающих прокариотное строение клетки со способностью осуществлять фотосинтез, сопровождающийся выделением O2, что свойственно разным группам водорослей и высших растений. Объединение черт, присущих организмам, относящимся к разным царствам или даже надцарствам живой природы, сделало цианобактерии объектом борьбы за принадлежность к низшим растениям (водорослям) или бактериям (прокариотам).
Вопрос о положении цианобактерии (сине-зеленых водорослей) в системе живого мира имеет долгую и противоречивую историю. В течение длительного времени они рассматривались как одна из групп низших растений, поэтому и систематика осуществлялась в соответствии с правилами Международного кодекса ботанической номенклатуры. И только в 60-х гг. XX в., когда было установлено четкое различие между прокариотным и эукариотным типами клеточной организации и на основании этого К. ван Нилем и Р. Стейниером сформулировано определение бактерий как организмов, имеющих прокариотное строение клетки, встал вопрос о пересмотре положения сине-зеленых водорослей в системе живых организмов.
Изучение цитологии клеток сине-зеленых водорослей с помощью современных методов привело к неоспоримому выводу о том, что эти организмы также являются типичными прокариотами. Как следствие этого Р. Стейниером было предложено отказаться от названия "сине-зеленые водоросли" и называть данные организмы "цианобактериями" — термином, отражающим их истинную биологическую природу. Воссоединение цианобактерий с остальными прокариотами поставило исследователей перед необходимостью пересмотра существующей классификации этих организмов и подчинения ее правилам Международного кодекса номенклатуры бактерий.
В течение длительного времени альгологами было описано около 170 родов и больше 1000 видов сине-зеленых водорослей. В настоящее время ведется работа по созданию новой систематики цианобактерий, основанной на изучении чистых культур. Уже получено больше 300 чистых штаммов цианобактерий. Для классификации использованы постоянные морфологические признаки, закономерности развития культуры, особенности клеточной ультраструктуры, величина и нуклеотидная характеристика генома, особенности углеродного и азотного метаболизма и ряд других.
Цианобактерий — морфологически разнообразная группа грамотрицательных эубактерий, включающая одноклеточные, колониальные и многоклеточные формы. У последних единицей структуры служит нить (трихом, или филамент). Нити бывают простые или ветвящиеся. Простые нити состоят из одного ряда клеток (однорядные трихомы), имеющих одинаковые размеры, форму и строение, или клеток, различающихся по этим параметрам. Ветвящиеся трихомы возникают в результате разных причин, в связи с чем различают ложное и истинное ветвление. К истинному ветвлению приводит способность клеток трихома делиться в разных плоскостях, в результате чего возникают многорядные трихомы или однорядные нити с однорядными же боковыми ветвями. Ложное ветвление трихомов не связано с особенностями деления клеток внутри нити, а есть результат прикрепления или соединения разных нитей под углом друг к другу.
В процессе жизненного цикла некоторые цианобактерий формируют дифференцированные единичные клетки или короткие нити, служащие для размножения (баеоциты, гормогонии), выживания в неблагоприятных условиях (споры, или акинеты) или азотфиксации в аэробных условиях (гетероцисты). Более подробная характеристика дифференцированных форм цианобактерий дана ниже при описании их систематики и процесса азотфиксации. Краткая характеристика акинет представлена в гл. 5. Для разных представителей этой группы характерна способность к скользящему движению. Оно свойственно как нитчатым формам (трихомы и/или гормогонии), так и одноклеточным (баеоциты).
Известны разные способы размножения цианобактерий. Деление клеток происходит путем равновеликого бинарного деления, сопровождающегося образованием поперечной перегородки или перетяжки; неравновеликого бинарного деления (почкования); множественного деления (см. рис. 20, А–Г). Бинарное деление может происходить только в одной плоскости, что у одноклеточных форм приводит к образованию цепочки клеток, а у нитчатых — к удлинению однорядного трихома. Деление в нескольких плоскостях ведет у одноклеточных цианобактерий к формированию скоплений правильной или неправильной формы, а у нитчатых — к возникновению многорядного трихома (если к такому делению способны почти все вегетативные клетки нити) или однорядного трихома с боковыми однорядными ветвями (если способность к делению в разных плоскостях обнаруживают только отдельные клетки нити). Размножение нитчатых форм осуществляется также с помощью обрывков трихома, состоящих из одной или нескольких клеток, у некоторых — также гормогониями, отличающимися по ряду признаков от трихомов, и в результате прорастания акинет в благоприятных условиях.
Начатая работа по классификации цианобактерий в соответствии с правилами Международного кодекса номенклатуры бактерий привела к выделению 5 основных таксономических групп в ранге порядков, различающихся морфологическими признаками (табл. 27). Для характеристики выделенных родов привлечены также данные, полученные при изучении клеточной ультраструктуры, генетического материала, физиолого-биохимических свойств.
К порядку Chroococcales отнесены одноклеточные цианобактерий, существующие в виде одиночных клеток или формирующие колонии (рис. 80). Для большинства представителей этой группы характерно образование чехлов, окружающих каждую клетку и, кроме того, удерживающих вместе группы клеток, т. е. участвующих в формировании колоний. Цианобактерий, клетки которых не образуют чехлов, легко распадаются до одиночных клеток. Размножение осуществляется бинарным делением в одной или нескольких плоскостях, а также почкованием.
Таблица 27. Основные таксономические группы цианобактерий
| Одноклеточные формы: одиночные клетки или колонии | Многоклеточные формы: нитчатые | |||
| Пор. Chroococcales | Пор. Pleurocapsales | Пор. Oscillatoriales | Пор. Nostocales | Пор. Stigoneomatales |
| Размножение бинарным делением в одной или более плоскостях или почкованием | Размножение множественным делением или чередованием бинарного и множественного деления | Трихомы неветвящиеся, состоят из одного ряда только вегетативных клеток. Рост трихома — делением клеток в одной плоскости | В неветвящихся однорядных трихомах помимо вегетативных образуются дифференцированные клетки: гетероцисты и иногда акинеты. Рост трихома — делением клеток в одной плоскости | Те же признаки, что и у представителей пор. Nostocales. Отличительный признак: способность вегетативных клеток трихома к делению более чем в одной плоскости, приводящему к появлению многорядных трихомов или трихомов с истинным ветвлением |
|
| Рис. 80. Цианобактерии, отнесенные к порядку Chroococcales: 1 — Gloeobacter; 2 — Gloeothece; 3 — Gloeocapsa; 4 — Synechococcus; 5 — Synechocystis; 6 — Chamaesiphon. Прерывистой линией обозначены чехлы, точками — капсулы, черточками — тилакоиды |
В порядок Pleurocapsales выделены одноклеточные цианобактерий, способные к размножению путем множественного деления. Они существуют в виде одиночных клеток или скоплений, удерживаемых вместе с помощью внешнего (по отношению к наружной мембране) фибриллярного слоя клеточной стенки. Скопления могут состоять всего из нескольких клеток разной формы, иметь кубическую или неправильную форму. Входящие в эту группу цианобактерий различаются способностью размножаться только множественным делением или чередованием процессов бинарного и множественного деления (рис. 81). Освобождающиеся в результате множественного деления баеоциты могут быть подвижными или неподвижными. У подвижных баеоцитов при освобождении из материнской клетки отсутствует дополнительный фибриллярный слой клеточной стенки. Подвижность их теряется, когда этот слой синтезируется. У неподвижных форм к моменту выхода из материнской клетки дополнительный слой клеточной стенки уже сформирован.
|
| Рис. 81. Циклы развития некоторых цианобактерий, включенных в порядок Pleurocapsales. А — цикл развития цианобактерий рода Dermocarpa: 1 — увеличение объема баеоцита до размеров вегетативной клетки; 2 — множественное деление, приводящее к образованию баеоцитов; 3 — разрыв материнской клетки и освобождение подвижных баеоцитов; 4 — синтез внешнего слоя клеточной стенки и потеря баеоцитом подвижности. Б — цикл развития цианобактерий рода Chroococcidiopsis: I — увеличение объема баеоцита до размеров вегетативной клетки; 2 — серия бинарных делений больше чем в одной плоскости; 3 — множественное деление части клеток колонии; 4 — освобожденные неподвижные баеоциты. Подвижные баеоциты обведены сплошной тонкой линией; неподвижные — сплошной жирной линией. Объяснения см. в тексте |
В отличие от рассмотренных выше цианобактерий в последующие порядки включены многоклеточные формы, имеющие нитчатое строение. Особенностью цианобактерий, отнесенных в порядок Oscillatoriales, является недифференцированность трихома (последний состоит только из вегетативных клеток) и его рост путем деления клеток в одной плоскости. Цианобактерии этой таксономической группы различаются строением трихомов и отдельных клеток, особенностями соединения клеток в трихоме, наличием или отсутствием чехла, способностью к движению и некоторыми другими морфологическими признаками (рис. 82). Для большинства представителей этой группы характерны прямые трихомы, клетки в которых дисковидные или цилиндрические плотно прилегают друг к другу или разделены глубокой перетяжкой. Трихомы могут быть окружены общим чехлом разной толщины. Скользящее движение свойственно цианобактериям, не образующим чехла или со слабым развитием последнего. К этой же группе относятся цианобактерии, имеющие подвижные спиралевидные трихомы, состоящие из клеток разной формы, не окруженные чехлом.
|
| Рис. 82. Цианобактерии, включенные в порядок Oscillatoriales: 1 — Spirulina; 2 — Oscillatoria; 3 — Pseudoanabaena |
Дальнейший шаг по пути морфологического усложнения сделан цианобактериями, включенными в порядок Nostocales (рис. 83). Они представлены однорядными неветвящимися нитями, рост которых происходит путем деления клеток в одной плоскости (под прямым углом к длинной оси трихома). При культивировании на среде без связанного азота некоторые вегетативные клетки дифференцируются в гетероцисты — центры азотфиксации в аэробных условиях. Ряд представителей группы образует акинеты — единственный тип покоящихся форм у цианобактерий. Размножение происходит короткими обрывками трихомов, морфологически не отличающимися от зрелых длинных нитей, и в результате прорастания акинет, если последние образуются. У некоторых цианобактерий в дополнение к описанным выше способам размножения для этой цели служат гормогоний. Последние представляют собой короткие нити, отличающиеся рядом морфологических признаков от родительского трихома: они состоят из небольшого числа мелких активно движущихся вегетативных клеток, иногда иной формы, чем клетки родительского трихома; могут содержать газовые вакуоли; никогда не окружены чехлом. Основное отличие гормогониев от зрелых и молодых трихомов — отсутствие гетероцист, даже если культура находится в среде, не содержащей связанного азота. Для выделения отдельных родов использованы такие признаки, как расположение гетероцист и акинет в нити, форма вегетативных клеток. В частности, трихом цианобактерий рода Calothrix образован клетками разной ширины, т. е. имеет асимметричное строение.
|
| Рис. 83. Цианобактерии, отнесенные к порядку Nostocales: А — Anabaena; Б — Nodularia; В — Cylindrospermum; Г — Nostoc; Д, — Scytonema; Е — Calothrix: 1 — трихом в зрелом состоянии; 2 — гормогоний; 3 — молодой трихом. Гетероцисты изображены в виде клеток с толстой клеточной стенкой и полярными гранулами; акинеты — в виде темных клеток. Прерывистой линией вдоль трихома обозначен чехол |
В порядок Stigonematales объединены цианобактерий, отличающиеся от представителей предыдущего порядка способностью вегетативных клеток трихома к делению более чем в одной плоскости (рис. 84). К этой группе отнесено несколько родов, различающихся циклами развития, расположением гетероцист в трихомах и некоторыми другими признаками.
Электронно-микроскопическое изучение вегетативных клеток цианобактерий обнаружило принципиальное сходство их строения с клетками грамотрицательных эубактерий. Более чем у 200 чистых культур определен состав оснований хромосомной ДНК. По этому признаку цианобактерии обнаруживают гетерогенность (молярное содержание ГЦ-оснований в ДНК от 35 до 71%), сравнимую только с остальными прокариотами (25-75%).
|
| Рис. 84. Цианобактерии порядка Stigonematales: А — Chlorogloeopsis; Б — Fischerella: 1 — зрелый трихом; 2 — гормогоний; 3 — молодой трихом. Обозначение гетероцист, акинет и чехла см. на рис. 83 |
В качестве одной из примечательных особенностей генетического материала цианобактерии отмечают значительные различия величины цианобактериальной хромосомы. Размеры геномов, изученные более чем у 100 штаммов из разных групп, располагаются в диапазоне 1,6 — 8,6-109 Да, при этом просматривается определенная корреляция между степенью морфологической сложности и величиной генома, достигающего максимальных значений у цианобактерии со сложной организацией трихомов и циклами развития. В группе цианобактерии сформирован самый крупный геном, обнаруженный до сих пор у прокариот. В то же время некоторые цианобактерии в отношении морфологической сложности также достигли вершины в мире прокариот и не имеют равных среди других грамотрицательных эубактерий.
Клетки цианобактерии, за исключением принадлежащих к роду Gloeobacter, характеризуются развитой системой внутрицитоплазматических мембран (тилакоидов), в которых локализованы компоненты фотосинтетического аппарата. Единственная энергопреобразующая мембрана Gloeobacter — цитоплазматическая, где локализованы процессы фотосинтеза и дыхания.
Большой интерес представляет группа цианобактерии из-за сосредоточения в ней разнообразных физиологических возможностей. В недрах этой группы, вероятно, сформировался и в целом оформился фотосинтез, основанный на функционировании двух фотосистем, характеризующийся использованием H2O в качестве экзогенного донора электронов и сопровождающийся выделением О2.
У цианобактерии обнаружена способность к бескислородному фотосинтезу, связанная с отключением II фотосистемы при сохранении активности I фотосистемы (см. рис. 75, В). В этих условиях у них возникает потребность в иных, чем H2O, экзогенных донорах электронов. В качестве последних цианобактерии могут использовать некоторые восстановленные соединения серы (H2S, Na2S2O3), H2, ряд органических соединений (сахара, кислоты). Так как поток электронов между двумя фотосистемами прерывается, синтез АТФ сопряжен только с циклическим электронным транспортом, связанным с I фотосистемой. Способность к бескислородному фотосинтезу обнаружена у многих цианобактерии из разных групп, но активность фиксации CO2 за счет этого процесса низка, составляя, как правило, несколько процентов от скорости ассимиляции CO2 в условиях функционирования обеих фотосистем. Только некоторые цианобактерии могут расти за счет бескислородного фотосинтеза, например Oscillatoria limnetica, выделенная из озера с высоким содержанием сероводорода. Способность цианобактерии переключаться при изменении условий с одного типа фотосинтеза на другой служит иллюстрацией гибкости их светового метаболизма, имеющей важное экологическое значение.
Хотя подавляющее большинство цианобактерии являются облигатными фототрофами, в природе они часто находятся длительное время в условиях темноты. В темноте у цианобактерии обнаружен активный эндогенный метаболизм, энергетическим субстратом которого служит запасенный на свету гликоген, катаболизируемый по окислительному пентозофосфатному циклу, обеспечивающему полное окисление молекулы глюкозы. На двух этапах этого пути с НАДФ-H2 водород поступает в дыхательную цепь, конечным акцептором электронов в которой служит O2.
O. limnetica, осуществляющая активный фотосинтез бескислородного типа, оказалась также способной в темноте в анаэробных условиях при наличии в среде серы осуществлять перенос электронов на молекулярную серу, восстанавливая ее до сульфида. Таким образом, анаэробное дыхание также может поставлять цианобактериям в темноте энергию. Однако насколько широко распространена такая способность среди цианобактерии, неизвестно. Не исключено, что она свойственна культурам, осуществляющим бескислородный фотосинтез.
Другой возможный путь получения цианобактериями в темноте энергии — гликолиз. У некоторых видов найдены все ферменты, необходимые для сбраживания глюкозы до молочной кислоты, однако образование последней, а также активности гликолитических ферментов низки. Кроме того, содержание АТФ в клетке в анаэробных условиях резко падает, так что, вероятно, жизнедеятельность цианобактерии только за счет субстратного фосфорилирования поддерживаться не может.
У всех изученных цианобактерии ЦТК из-за отсутствия a-кетоглутаратдегидрогеназы "не замкнут" (рис. 85). В таком виде он не функционирует в качестве пути, ведущего к получению энергии, а выполняет только биосинтетические функции. Способность в той или иной степени использовать органические соединения для биосинтетических целей присуща всем цианобактериям, но только некоторые сахара могут обеспечивать синтез всех клеточных компонентов, являясь единственным или дополнительным к CO2 источником углерода.
Цианобактерии могут ассимилировать некоторые органические кислоты, в первую очередь ацетат и пируват, но всегда только в качестве дополнительного источника углерода. Метаболизирование их связано с функционированием "разорванного" ЦТК и приводит к включению в весьма ограниченное число клеточных компонентов (рис. 85). В соответствии с особенностями конструктивного метаболизма у цианобактерии отмечают способность к фотогетеротрофии или облигатную привязанность к фотоавтотрофии. В природных условиях часто цианобактерии осуществляют конструктивный метаболизм смешанного (миксотрофного) типа.
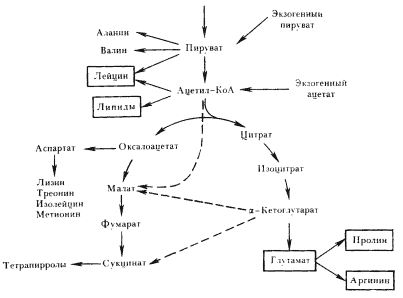
|
| Рис 85. "Разорванный" ЦТК у цианобактерий. Обведены продукты метаболизирования экзогенного ацетата. Пунктирными линиями изображены реакции глиоксилатного шунта |
Некоторые цианобактерии способны к хемогетеротрофному росту. Набор органических веществ, поддерживающих хемогетеротрофный рост, ограничен несколькими сахарами. Это связывают с функционированием у цианобактерий в качестве основного катаболического пути окислительного пентозофосфатного цикла, исходным субстратом которого служит глюкоза. Поэтому только последняя или сахара, ферментативно легко превращаемые в глюкозу, могут метаболизироваться по этому пути.
Одна из загадок метаболизма цианобактерий — неспособность большинства из них расти в темноте с использованием органических соединений. Невозможность роста за счет субстратов, метаболизируемых в ЦТК, связана с "разорванностью" этого цикла. Но основной путь катаболизма глюкозы — окислительный пентозофосфатный цикл — функционирует у всех изученных цианобактерий. В качестве причин называют неактивность систем транспорта экзогенных сахаров в клетку, а также низкую скорость синтеза АТФ, сопряженного с дыхательным электронным транспортом, вследствие чего количество вырабатываемой в темноте энергии достаточно только для поддержания клеточной жизнедеятельности, но не роста культуры.
Цианобактерии, в группе которых, вероятно, сформировался кислородный фотосинтез, впервые столкнулись с выделением O2 внутри клетки. Помимо создания разнообразных систем защиты от токсических форм кислорода, проявляющихся в устойчивости к высоким концентрациям O2, цианобактерии адаптировались к аэробному способу существования путем использования молекулярного кислорода для получения энергии.
В то же время для ряда цианобактерий показана способность расти на свету в строго анаэробных условиях. Это относится к видам, осуществляющим фотосинтез бескислородного типа, которых в соответствии с принятой классификацией следует отнести к факультативным анаэробам. (Фотосинтез любого типа по своей природе — анаэробный процесс. Это хорошо видно в случае фотосинтеза бескислородного типа и менее очевидно для кислородного фотосинтеза). Для некоторых цианобактерий показана принципиальная возможность протекания темновых анаэробных процессов (анаэробное дыхание, молочнокислое брожение), однако низкая активность ставит под сомнение их роль в энергетическом метаболизме цианобактерий. Зависимые и не зависимые от O2 способы получения энергии, обнаруженные в группе цианобактерий, суммированы в табл. 28.
Конструктивный метаболизм цианобактерий представляет собой шаг вперед по пути дальнейшей независимости от органических соединений внешней среды по сравнению с пурпурными и зелеными серобактериями. Для построения всех веществ клетки цианобактериям нужен минимум простых неорганических соединений: углекислота, самые простые формы азота (аммонийные, нитратные соли или молекулярный азот), минеральные соли (источники фосфора, серы, магния, железа, микроэлементов), вода. Цианобактерии не требуют никаких питательных компонентов в восстановленной форме. Только некоторые морские виды обнаруживают потребность в витамине B12.
Азотфиксирующая активность выявлена более чем у 250 штаммов, принадлежащих к разным группам фототрофных эубактерий. Примерно половину из них составляют цианобактерии. Способность последних к фиксации N2, определяемая по наличию нитрогеназной активности, зависит от условий, и в первую очередь от содержания в среде связанного азота и молекулярного кислорода. Основное место действия обоих факторов — нитрогеназа. В первом случае источники связанного азота репрессируют синтез и ингибируют активность фермента, во втором — O2 быстро инактивирует его.
Отрицательное действие O2 на азотфиксацию связано с восстановительной природой процесса. Возникшая первоначально у анаэробных прокариот, получающих энергию за счет брожения, способность к азотфиксации проявилась и в группах эубактерий с бескислородным фотосинтезом. Благоприятные условия для нее обеспечивались анаэробным типом метаболизма этих групп. И только цианобактерий столкнулись с проблемой функционирования в клетке двух процессов, один из которых имеет восстановительную природу, а другой сопровождается выделением такого сильного окислителя, как O2. Возникла необходимость защиты или изолирования процесса азотфиксации от молекулярного кислорода.
Таблица 28. Способы получения энергии в группе цианобактерий
| Способ получения энергии | Донор электронов | Акцептор электронов | Распространенность и физиологический эффект |
| Фотосинтез кислородного типа | H2O | НАДФ+, ферредоксин | обеспечивает рост всех цианобактерий |
| Фотосинтез бескислородного типа | H2S, Na2S2O3, H2, органические соединения | НАДФ+ ферредоксин | обеспечивает рост некоторых изученных видов; у большинства — снабжает энергией, необходимой для поддержания жизнедеятельности |
| Дыхание | НАД(Ф)-H2 | O2 | обеспечивает рост факультативно фототрофных цианобактерий и поддержание жизнедеятельности облигатно фототрофных видов |
| H2* | O2 | может быть связано с получением энергии | |
| Анаэробное дыхание | НАД(Ф)-H2 | S0 | поддерживает жизнедеятельность некоторых цианобактерий, способных к бескислородному фотосинтезу |
| Брожение | эндогенные или экзогенные сахара | пируват | обнаружено у некоторых факультативно анаэробных цианобактерий; активность недостаточна для поддержания жизнедеятельности** |
* Разные представители цианобактерий оказались способными использовать в темноте молекулярный водород при наличии в качестве акцептора электронов O2. Имеются данные в пользу того, что потребление На связано с функционированием дыхательной цепи и может вести к получению энергии.
** Есть только одно сообщение о способности цианобактерий рода Nostoc расти в темноте в анаэробных условиях, осуществляя сбраживание некоторых сахаров.
Вегетативные клетки многих изученных культур обнаруживают нитрогеназную активность в анаэробных и микроаэробных условиях. Только для единичных культур, например представителей рода Gloeothece, показана способность вегетативных клеток к азотфиксации в аэробных условиях, при этом до 95% фиксированного азота приходится на темновой период, т. е. процессы фотосинтеза и азотфиксации разделены во времени. В целом же проблема фиксации N2 в аэробных условиях значительной частью цианобактерий решена путем формирования дифференцированных клеток определенного типа — гетероцист, в которых чувствительный к O2 аппарат фиксации молекулярного азота отделен от фотосинтетического аппарата с помощью определенных ультраструктурных и биохимических перестроек. Таким образом, способность подавляющего большинства цианобактерий к азотфиксации в аэробных условиях связана с гетероцистами.
При отсутствии в среде связанного азота некоторые вегетативные клетки (обычно 5–10%) нитчатых цианобактерий, принадлежащих к порядкам Nostocales и Stigonematales, превращаются в гетероцисты, образование которых происходит в течение 24 ч параллельно с развитием нитрогеназной активности и может быть разделено на два этапа. Прогетероцисты, формирующиеся на первом этапе, характеризуются неспособностью обеспечить защиту нитрогеназы от инактивирующего действия O2, а также тем, что процесс дифференцировки на этой стадии обратим. На втором этапе процесс дифференцировки становится необратимым. Сформированные гетероцисты не способны к делению и не могут превращаться в вегетативные клетки.
Формирование гетероцист из вегетативных клеток сопровождается глубокими ультраструктурными и функциональными перестройками (рис. 86, А). Зрелые гетероцисты окружены тремя дополнительными слоями, внешними по отношению к клеточной стенке, что затрудняет проницаемость в них воды, ионов, нейтральных веществ гидрофильной природы и растворенных газов. Дополнительные слои, окружающие гетероцисту, в местах ее контакта с вегетативной клеткой прерываются. Перегородка, отделяющая гетероцисту от вегетативной клетки, пронизана множеством мелких каналов (микроплазмодесм), соединяющих цитоплазмы обеих клеток и обеспечивающих обмен клеточными метаболитами. В цитоплазме гетероцист в зонах контакта с вегетативными клетками располагаются светопреломляющие полярные гранулы цианофицина.
Значительную реорганизацию претерпевает в гетероцистах система фотосинтетических мембран: они укорачиваются, теряют расположение, характерное для вегетативных клеток; как правило, отмечается скопление тилакоидов вблизи полюсов гетероцисты. Морфологические изменения тилакоидов сочетаются с важными перестройками фотосинтетического аппарата на функциональном уровне. В гетероцистах не работает II фотосистема. Следовательно, внутриклеточный O2 в них не образуется. Потеря активности II фотосистемы коррелирует со следующими биохимическими особенностями гетероцист: отсутствием основных светособирающих пигментов II фотосистемы — фикобилипротеинов и содержащих их структур — фикобилисом; резко пониженным содержанием ионов марганца — необходимого компонента системы разложения воды; потерей гетероцистами способности фиксировать CO2, связанной с отсутствием рибулозодифосфаткарбоксилазы в растворимой форме или в виде карбоксисом. Деградация II фотосистемы сопровождается сохранением активности I фотосистемы, что находит отражение в поддержании значительного уровня хлорофилла a и увеличении числа реакционных центров этой фотосистемы.
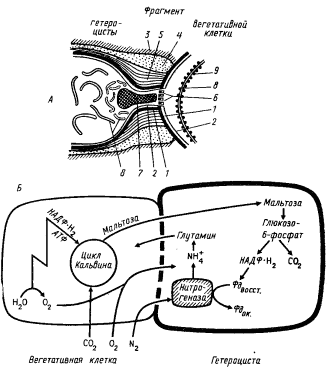
|
| Рис. 86. Схема строения гетероцисты (А) и обмена углеродными и азотными соединениями между гетероцистой и вегетативной клеткой (Б): 1 — клеточная стенка; 2 — ЦПМ; 3 — фибриллярный слой; 4 — гомогенный слой; 5 — пластинчатый слой оболочки гетероцисты; 6 — микроплазмодесмы; 7 — полярная цианофициновая гранула; 8 — тилакоиды; 9 — фикобилисомы |
В процессе формирования гетероцист наблюдается исчезновение различных цитоплазматических включений, характерных для вегетативных клеток: гликогеновых, полифосфатных гранул. В то же время в гетероцистах сохраняется в полном объеме генетическая информация, и в процессе их жизнедеятельности отмечаются активные процессы синтеза РНК и белка. На генетическую "полноценность" гетероцист указывают и неоднократно наблюдавшиеся факты их прорастания и деления.
Для фиксации N2 необходим восстановитель в виде молекул восстановленного ферредоксина (иногда НАДФ-H2) и химическая энергия в форме АТФ. Из-за отсутствия в гетероцистах нециклического транспорта электронов они не могут обеспечивать процесс азотфиксации фотохимически образованным восстановителем и зависят в этом отношении от межклеточного переноса метаболитов (рис. 86, Б). Восстановитель может или непосредственно транспортироваться из соседних вегетативных клеток в готовом виде, или же генерироваться в гетероцистах в темновых ферментативных процессах из исходного транспортируемого субстрата. В последнем случае таким субстратом служит дисахарид мальтоза — продукт восстановительного пентозофосфатного цикла. Ее катаболизирование, осуществляемое по активно функционирующему в гетероцистах окислительному пентозофосфатному пути, приводит к образованию молекул НАДФ-H2, с которых водород может передаваться на ферредоксин в реакции, катализируемой ферредоксин: НАДФ-оксидоредуктазой. Источником АТФ в гетероцистах на свету служит зависимое от I фотосистемы циклическое фотофосфорилирование, в темноте — окислительное фосфорилирование.
Нитрогеназная система катализирует восстановление N2 до аммония. Последний включается в молекулу глутаминовой кислоты в реакции, катализируемой глутаминсинтетазой:
В таком виде фиксированный азот транспортируется из гетероцист в вегетативные клетки, где с помощью глутаматсинтазы осуществляется перенос амидной группы на молекулу a-кетоглутарата:
Одна из молекул глутамата возвращается в гетероцисту для очередного акцептирования NH4+, другая поступает в метаболизм вегетативной клетки.
Таким образом, все структурные и функциональные перестройки, происходящие в процессе формирования гетероцист, направлены на поддержание высокой активности нитрогеназы, что достигается, с одной стороны, путем эффективного ее снабжения восстановителем и энергией, с другой — защитой от молекулярного кислорода за счет уменьшения проникновения O2 через утолщенные оболочки гетероцист, реорганизации их фотосинтетического аппарата и высокой активности дыхания.
Прохлорофиты
Обнаружены эубактерии, осуществляющие фотосинтез кислородного типа, весьма сходные с цианобактериями, но отличающиеся от них составом фотосинтетических пигментов: отсутствием фикобилипротеинов и наличием хлорофилла b. Организмы названы прохлорофитами60. В IX издании Определителя бактерий Берги они выделены в порядок Prochlorales. В составе порядка 3 рода, различающихся морфологическими и некоторыми физиолого-биохимическими признаками. Это одноклеточные (сферические) или многоклеточные (нитчатые) формы, неподвижные или подвижные. Размножаются бинарным делением. Клеточная стенка грамотрицательного типа, напоминает таковую цианобактерий. Нити ДНК, не отграниченные от цитоплазмы мембраной, располагаются в центральной области клетки.
60 Первый представитель этой группы был описан в 1975 г. Р. А. Левиным (R. A. Lewin). Им же было предложено название, в котором отражено представление об этих организмах как о возможных предшественниках эукариотных зеленых водорослей (Chlorophyta), произошедших от подобных прокариот или путем длительного процесса внутриклеточной дифференцировки, или же в результате симбиогенеза. В последнем случае Прохлорофиты — предки хлоропластов.
Большую часть цитоплазмы занимают тилакоиды, располагающиеся обычно концентрическими кругами по периферии клетки. Тилакоиды, как и у цианобактерий, лежат в цитоплазме "свободно", т. е. не отделены от нее замкнутой мембраной, и имеют тенденцию сближаться, образуя пары или стопки, состоящие из трех и более тилакоидов. Внутренние и наружные поверхности тилакоидных мембран гладкие. Фикобилисомы и фикобилипротеины не обнаружены.
Фотосинтетические пигменты представлены хлорофиллами a и b и каротиноидами. Основную массу последних составляют b-каротин и ксантофилл, близкий к зеаксантину. Обнаружено несколько каротиноидов в незначительных количествах, среди которых идентифицированы эхиненон, b-криптоксантин, изо- криптоксантин и др. Все эти каротиноиды найдены и у цианобактерий. По составу жирных кислот и гликолипидов прохлорофиты также близки к цианобактериям. В цитоплазме обнаружены 70S-рибосомные частицы, содержащие РНК 16S- и 23S-типов, аналогично рибосомальным РНК прокариот и хлоропластов эукариот. Молярное содержание ГЦ в ДНК — 39 — 53%.
CO2 активно фиксируется в восстановительном пентозофосфатном цикле, о чем свидетельствуют активности двух специфических ферментов этого пути: рибулозодифосфаткарбоксилазы и фосфорибулокиназы. Первый фермент содержится в клетке также в карбоксисомах и состоит из 8 больших и малых субъединиц, что характерно для рибулозодифосфаткарбоксила-зы цианобактерий и зеленых водорослей. Конечным продуктом углеродного метаболизма на свету является полисахарид, схожий с гликогеном цианобактерий. Помимо фотоавтотрофии обнаружена способность прохлорофит к фотогетеротрофии и росту в темноте с получением энергии в процессе дыхания. Для некоторых представителей группы показана способность фиксировать N2.
Как и цианобактерий, Прохлорофиты сталкиваются с проблемой внутриклеточного O2, который они, с одной стороны, способны использовать, обнаруживая склонность к микроаэрофилии, с другой — имеют определенные системы защиты от его токсических форм. В качестве одной из защитных систем обнаружена супероксиддисмутаза FeMn-типа, характерная для прокариотных форм. Первый представитель этой группы, отнесенный к роду Prochloron, был обнаружен на поверхности тела морских животных — колониальных асцидий61. Длительное время не удавалось культивировать Prochloron в лабораторных условиях. Недавно было обнаружено, что зависимость от хозяина определяется потребностью Prochloron в аминокислотах, в частности в триптофане. Свободноживущая форма, отнесенная к роду Prochlorothrix, обнаружена в пресном озере в 1986г. Она легко получена в чистой культуре и способна расти на минеральной среде.
61 Асцидии относятся к низшим хордовым, классу Ascidiae, объединяющему около тысячи одиночных и колониальных видов. Обитают только в морях. Тело асцидий покрыто туникой, имеющей сложное строение-Скопления клеток Prochloron обнаружены в области ротового или клоакального сифонов или погружены в материал туники.
Прохлорофиты привлекают к себе большое внимание в связи с проблемами эволюции фотосинтетического аппарата и возникновения фотосинтезирующих эукариот. Сравнение прохлорофит с цианобактериями и хлоропластами зеленых водорослей и высших растений обнаруживает черты сходства как с фотосинтетическими органеллами эукариот (организация тилакоидов, состав хлорофиллов), так и с цианобактериями (клеточное строение, состав каротиноидов, липидов, некоторые особенности метаболизма, последовательность оснований 16S рРНК). Для ответа на вопрос, в каком отношении Прохлорофиты находятся с цианобактериями (развивались ли независимо и параллельно с цианобактериями, возникли ли из их предшественников, потерявших способность синтезировать фикобилипротеины, или наоборот цианобактерий возникли из прохлорофит), необходимо дальнейшее сравнительное изучение обеих групп эубактерии с фотосинтезом кислородного типа. Прохлорофиты рассматриваются в качестве возможных эндосимбионтов, последующая эволюция которых привела к возникновению хлоропластов зеленых водорослей и высших растений.
ФОТОТРОФНЫЕ ЭУБАКТЕРИИ В ПРИРОДЕ
Три основных фактора определяют распространение фототрофных эубактерий в природе: свет, молекулярный кислород и питательные вещества. Потребности в разных частях солнечного спектра для фотосинтеза определяются набором светособирающих пигментов. Эубактерий с кислородным типом фотосинтеза поглощают свет в том же диапазоне длин волн, что водоросли и высшие растения (см. рис. 71). Пурпурные и зеленые бактерии часто развиваются в водоемах под более или менее плотным поверхностным слоем, состоящим из цианобактерий и водорослей, эффективно поглощающих свет до 750 нм. Фотосинтез пурпурных и зеленых бактерий в этих условиях связан со способностью бактериохлорофиллов поглощать свет в красной и инфракрасной областях спектра за пределами поглощения хлорофиллов. Крайняя граница этой части спектра определяется способностью бактериохлорофилла b некоторых пурпурных бактерий поглощать свет с длиной волны до 1100 нм. Некоторые фотосинтезирующие эубактерий могут расти в водоемах на глубине до 20–30 м, что осуществляется за счет активности другой группы пигментов — каротиноидов. Известно, что различные лучи солнечного спектра поглощаются водой с разной интенсивностью. Глубже всего проникает свет голубой и зеленой частей спектра (450–550 нм), сильнее поглощается ультрафиолет и красный свет. Содержащиеся в клетках некоторых фототрофных эубактерий каротиноиды активно поглощают свет с длиной волны в области 460 нм, обеспечивая этим бактериям рост на значительных глубинах, куда проникает только свет этой части спектра.
В отношении к молекулярному кислороду среди фототрофных эубактерий на одном полюсе располагаются строгие анаэробы, на другом — организмы, у которых O2 образуется внут-риклеточно. Многие виды — факультативные анаэробы, есть аэротолерантные формы и микроаэрофилы. У фотосинтезирующих эубактерий молекулярный кислород часто выступает как могучий фактор, регулирующий их метаболизм: в аэробных условиях у пурпурных и зеленых бактерий репрессируется синтез фотосинтетических пигментов и тем самым уничтожается основа для фототрофного способа существования.
Значительны различия в питательных веществах, необходимых для построения веществ клетки, и донорах электронов. Диапазон — от облигатной зависимости от органических соединений, характерной для гелиобактерий и некоторых пурпурных бактерий, до способности расти на минеральной среде, свойственной цианобактериям и несимбиотическим прохлорофитам. К другим факторам внешней среды, определяющим рост фототрофных эубактерий, относятся pH, температура, концентрация солей.
Пурпурные и зеленые серобактерии, характеризующиеся близкими потребностями в факторах среды, часто сосуществуют вместе в освещенных анаэробных водных средах (пресных или соленых), богатых сульфидом. Пурпурные несерные бактерии имеют свою экологическую нишу. Как правило, они не развиваются в зонах активного роста фототрофных серобактерий. Благоприятные условия для роста несерных пурпурных бактерий, более чувствительных к сульфиду, но менее чувствительных к O2, создаются в местах, богатых органическими веществами.
Первый представитель зеленых нитчатых бактерий Chloroflexus aurantiacus был выделен из термального источника, где рос, формируя пленку толщиной несколько миллиметров. Позднее термофильные штаммы этого вида были найдены во многих нейтральных и щелочных горячих источниках с температурой от 45 до 75°, где условия, как правило, микроаэробные. Часто Chloroflexus образует смешанные популяции с термофильными цианобактериями рода Synechococcus. Вскоре из природных слоев пресных озер были выделены мезофильные аналоги Chloroflexus с оптимальной температурой роста 20–25°.
В группе цианобактерий достигнуто наибольшее среди фототрофных эубактерий приспособление к широкому диапазону внешних условий, определившее их почти повсеместное распространение. Эти организмы встречаются во льдах и горячих источниках с температурой до 70–80°, обитают в пресных водоемах разного типа, морях и океанах, в почвах и пустынях. В экономическую проблему выросло наблюдаемое в ряде водоемов чрезмерное массовое развитие цианобактерий, поскольку виды, доминирующие в этом процессе, токсичны для беспозвоночных, рыб и домашних животных. Подобные явления описаны для ряда внутренних водоемов нашей страны и других стран мира.
Некоторые фототрофные эубактерий существуют в ассоциациях с другими организмами. Таковы ассоциации ряда зеленых серобактерий с хемоорганотрофными бактериями, прохло- рофит с асцидиями, цианобактерий с грибами, мхами, папоротниками, водорослями, высшими растениями. Если в симбиозах один из компонентов — азотфиксирующие цианобактерий, они в первую очередь снабжают партнера связанным азотом. В других случаях конкретная природа связей между симбионтами неясна.
Фототрофные эубактерий, особенно цианобактерий, играют значительную роль в круговороте углерода и азота, а серобактерии — и серы. Сделаны определенные шаги на пути практического использования фототрофных эубактерий, например, применения азотфиксирующих цианобактерий для повышения плодородия рисовых полей, культивирования пурпурных бактерий и цианобактерий в промышленных масштабах для получения кормового белка и перспективного источника энергии — молекулярного водорода.
В научном плане фототрофные эубактерии представляют интерес для изучения механизма фотосинтеза и азотфиксации. На прокариотном уровне сформировался тип фотосинтеза, сопровождающийся выделением в атмосферу O2. С этого момента начался новый этап в эволюции жизни, решающим фактором в котором явился молекулярный кислород.
М.В.Гусев, Л.А.Минеева © 1992-2001
Кафедра клеточной физиологии и иммунологии биологического факультета МГУ им. М.В.Ломоносова © 2000-2001
Страница обновлена 09.09.01
Оформление: А.В.Киташов