ГЛАВА 18. ГРУППЫ АРХЕБАКТЕРИЙ
ЭКСТРЕМАЛЬНЫЕ ГАЛОФИЛЫ
Длительное время считали, что без участия хлорофилла фотосинтез невозможен. Способность некоторых экстремально галофильных архебактерий осуществлять фотосинтез бесхлорофилльного типа была обнаружена в начале 70-х гг. Д. Остерхельтом и В. Стокениусом (D. Oesterhelt, W. Stoeckenius), идентифицировавшими в ЦПМ Halobacterium salinarium72 бактериородопсин — белок, ковалентно связанный с каротиноидом, и показавшими способность этого белка к светозависимому переносу протонов через мембрану, приводящему в конечном итоге к синтезу АТФ. Фотофосфорилирование, обнаруженное у этих архебактерий, — единственный пример превращения энергии света в химическую энергию АТФ без участия электронтранспортной цепи.
Галофильные архебактерий распространены там, где есть подходящие для этого условия с высоким содержанием NaCl и других необходимых ионов: в природных соленых водоемах, бассейнах для выпаривания соли, белковых материалах, консервируемых с помощью соли (рыба, мясо, шкуры). Могут расти в насыщенном растворе NaCl (30%). Нижний предел концентрации соли для роста большинства видов составляет 12-15% (2-2,5 М); оптимальное содержание — между 20 и 26% (3,5-4,5 М). Высоки потребности галобактерий и в других ионах: оптимальный уровень Mg2+ в среде — 0, 1 — 0, 5 М, K+ — примерно 0,025 М.
72 Прежнее название — Halobacterium halobium.
Влияние ионов на галобактерий достаточно специфично. Для поддержания клеточной стабильности в первую очередь требуется хлористый натрий. Ионы Na+ взаимодействуют с отрицательно заряженными молекулами клеточной стенки галобактерий и придают ей необходимую жесткость. Внутри клетки концентрация NaCl невысока. Основной внутриклеточный ион — K+, содержание которого может составлять от 30 до 40% сухого вещества клеток, а градиент между внеклеточной и внутриклеточной концентрациями достигать 1:1000. Ионы K+ (наряду с другими) необходимы для поддержания ионного равновесия вне и внутри клетки, стабилизации ферментов, мембран и других клеточных структур.
В IX издании Определителя бактерий Берги экстремально галофильные архебактерии объединены в порядок Halobacteriales семейство Halobacteriaceae и включает 6 родов и более 20 видов, различающихся формой клеток (палочки, кокки, квадраты), способностью к движению, отношением к кислотности среды, устойчивостью к NaCl и другими признаками.
В составе клеточных стенок не обнаружен пептидогликан. У представителей рода Halobacterium клеточная стенка толщиной 15–20 нм построена из регулярно расположенных гексагональных субъединиц, состоящих в основном из гликопротеинов. Клеточная стенка галобактерий рода Halococcus имеет толщину 50–60 нм и состоит из гетерополисахаридов.
ЦПМ содержит около 1/3 липидов и 2/3 разных белков, включая обычные для эубактериальных мембран наборы флавопротеинов и цитохромов. Основная масса липидов экстремальных галофилов отличается от характерных для эубактерий липидов тем, что в их молекуле глицерин связан не с остатками жирных кислот, а с C20-терпеноидным спиртом — фитанолом. Фосфолипидные и гликолипидные производные глицеринового диэфира могут в определенных условиях составлять до 80% общего содержания липидов в клетках. Помимо уникальных липидов клеточные мембраны экстремальных галофилов содержат много каротиноидных пигментов (основной — бактериоруберин), обусловливающих окраску колоний от розового до красного цвета, что имеет для галофилов немаловажное значение как средство защиты против избыточной радиации, поскольку для их мест обитания характерна обычно высокая освещенность.
При недостатке в среде O2 в ЦПМ галобактерий индуцируется синтез хромопротеина — бактериородопсина, белка, соединенного ковалентной связью с C20-каротиноидом ретиналем (рис. 104, А). Свое название хромопротеин получил из-за сходства с родопсином — зрительным пигментом сетчатки позвоночных. Оба белка содержат в качестве хромофорной группы ретиналь, различаясь строением полипептидной цепи. Бактериородопсин откладывается в виде отдельных пурпурных областей (бляшек) на ЦПМ красного цвета, обусловленного высоким содержанием каротиноидов. При выращивании клеток на свету в условиях недостатка O2 пурпурные участки могут составлять до 50% поверхности мембраны. В них содержится от 20 до 25% липидов и только один белок — бактериородопсин. При удалении из среды солей клеточная стенка растворяется, а ЦПМ распадается на мелкие фрагменты, при этом участки мембраны красного цвета диссоциируют, а пурпурные бляшки сохраняются и могут быть получены в виде отдельной фракции.
Генетический материал экстремальных галофилов представлен в виде основной и сателлитных ДНК. Последние составляют от 11 до 30% всей содержащейся в клетках ДНК и состоят из замкнутых кольцевых молекул. Основная и сателлитные ДНК различаются нуклеотидным составом: молярное ГЦ-содержание основной ДНК — порядка 66–68, а сателлитных — 57–60%. Высокий уровень сателлитных ДНК — уникальная черта организации генетического материала экстремальных галофилов, значение которой пока не ясно. Предполагается, что сателлитные ДНК — не эписомы, а составная часть генома этих бактерий.

|
| Рис. 104. Ретиналь (А) и предполагаемая организация бактериородопсина в пурпурной мембране (Б): Р — ретиналь; 1 — полипептидная цепь; 2 — липид (по Овчинникову, 1982) |
Экстремальные галофилы имеют сложные пищевые потребности. Для роста большинства видов в состав сред должны входить дрожжевой экстракт, пептон, гидролизат казеина, набор витаминов. Высокой требовательностью к среде отличаются представители родов Halobacterium и Halococcus. Основным источником энергии и углерода служат аминокислоты и углеводы. Метаболизм глюкозы осуществляется по модифицированному пути Энтнера–Дудорова, отличающемуся тем, что глюкоза без фосфорилирования окисляется в глюконовую кислоту. Последняя превращается в 2-кето-З-дезоксиглюконовую кислоту, которая расщепляется на два C3-фрагмента: пировиноградную кислоту и глицериновый альдегид. Из глицеринового альдегида в результате нескольких ферментативных преобразований также образуется пировиноградная кислота (рис. 105). Дальнейшее ее окисление происходит в замкнутом ЦТК.
Основной способ получения энергии экстремальными галофилами — аэробное дыхание. В ЦПМ обнаружены цитохромы b, c, а также цитохромоксидаза о-типа. Электроны в дыхательную цепь поступают с НАД-зависимых дегидрогеназ. В анаэробных условиях в темноте источником энергии может служить анаэробное дыхание с использованием NO3 в качестве конечного акцептора электронов, а также процесс сбраживания аргинина и цитрулина. Свет служит дополнительным источником энергии, аппарат для использования которого подключается при недостатке O2.

|
| Рис. 105. Схема модифицированного пути Энтнера–Дудорова |
В клетках Н. salinarium и некоторых других галобактерий обнаружены 3 фотоактивных пигмента, все они ретинальсодержащие белки. Один из них, названный сенсорным родопсином (5-родопсин), обеспечивает фототактическую реакцию бактерий. Красный и желто-синий свет действуют на них как аттрактанты, синий и УФ — как репелленты. S-родопсин существует в двух спектрально различных формах, каждая из которых претерпевает фотохимические превращения. Поглощение фотона красного света приводит к генерированию сигнала, по которому бактерии начинают перемещаться в направлении к источнику света. При поглощении фотона синего света наблюдается противоположная реакция. Максимальный эффект в обоих случаях достигается при длине волны 565 и 370 нм соответственно. Фотосенсорная реакция обеспечивает оптимальную для клеток галобактерий пространственную ориентацию. Клетки покидают области, в которые проникает губительное коротковолновое излучение и с помощью жгутиков или газовых вакуолей концентрируются в зонах с благоприятным для них световым режимом. Этим достигаются и оптимальные условия для фотофосфорилирования, так как область спектра, вызывающая положительную тактическую реакцию, и спектр поглощения фотосинтетического пигмента совпадают.
Использование световой энергии для создания трансмембранного градиента протонов происходит с участием бактериородопсина и не связано с переносом электронов по цепи переносчиков. Этот хромопротеин с молекулярной массой 26 кДа содержит полипептидную цепь, построенную из 248 аминокислотных остатков и на 75% состоящую из a-спиральных участков. Последние образуют 7 тяжей, ориентированных перпендикулярно плоскости мембраны (см. рис. 104, Б). Ретиналь расположен параллельно плоскости мембраны и, следовательно, перпендикулярно белковым тяжам. Связь между ретиналем и полипептидной цепью осуществляется через Шиффово основание, образованное в результате взаимодействия альдегидной группы ретиналя с e-аминогруппой 216-го лизинового остатка:

Шиффово основание в темноте находится в протонированной форме. Поглощение кванта света бактериородопсином вызывает изменение конформации ретиналя и приводит к отщеплению H+ от Шиффова основания:
Бактериородопсин, в молекуле которого Шиффово основание находится в протонированной форме, поглощает свет с длиной волны 570 нм, а в депротонированной — при 412 нм. Протон, отделившийся на свету от Шиффова основания, переходит во внеклеточное пространство, а Н+, протонирующий Шиффово основание, поглощается из цитоплазмы. Таким образом, под действием света бактериородопсин "перебрасывает" протоны с одной стороны мембраны на другую. В результате работы циклического механизма, получившего название бактериородопсиновой протонной помпы, при освещении по разные стороны мембраны возникает градиент концентрации Н+, достигающий 200 мВ, в создании которого участвуют электрический и химический компоненты. Разрядка DmH+ с помощью Н+-АТФ-синтазы приводит к синтезу АТФ (рис. 106). Бактериородопсин — простейший из известных генераторов DmH+ Несмотря на кажущуюся простоту, очевидно, что бактериородопсиновая протонная помпа представляет собой сложную систему. Прежде всего путь, который должен пройти Н+, чтобы пересечь мембрану, составляет не менее 5 нм, т. е. значительно превышает расстояние, на которое он может быть перенесен; при любом конформационном изменении ретиналя. Это означает, что поглощение кванта света должно приводить к возникновению напряженной конформации всего бактериородопсинового комплекса, служащей в дальнейшем источником энергии для переноса Н+ против электрохимического градиента. В организации такого переноса принимают участие ориентированные поперек мембраны a-спиральные тяжи и мембранные липиды, формирующие протонные каналы, природа и механизм действия которых пока не известны.
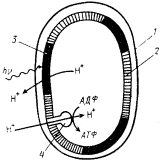
|
| Рис. 106. Схема работы бак-териородопсиновой протонной помпы: 1 — клеточная стенка; 2 — красная мембрана; 3 — пурпурная мембрана; 4 — Н+-АТФ-синтаза (по Stoeckenius, 1976) |
Экстремально галофильные архебактерии содержат еще один ретинальбелковый комплекс — галородопсин, закачивающий на свету в клетки ионы хлора. Создающийся трансмембранный градиент Cl– используется для синтеза АТФ. Одновременно этим обеспечивается также поддержание в цитоплазме высокой концентрации анионов, необходимой для уравновешивания высокой ионной силы внешней среды.
Могут ли экстремальные галофилы расти за счет энергии света или он служит только дополнительным источником энергии? В лаборатории был показан рост этих бактерий в анаэробных условиях, исключающих возможность осуществления брожения или анаэробного дыхания, при освещении клеток, если они содержат значительные количества бактериородопсина или если в среду внесен ретиналь, для синтеза которого необходим молекулярный кислород. Таким образом, в условиях эксперимента для экстремальных галофилов установлена способность получать всю необходимую для роста энергию за счет процесса фотосинтеза.
Место галофильных архебактерии в экосистеме прокариот связано с их участием в циклах углерода и азота в нишах с высоким содержанием соли и нейтральной (представители родов Halobacterium, Halococcus и др.) или щелочной (роды Natronobacterium, Natronococcus) реакцией среды.
Вопрос о происхождении бесхлорофилльного фотосинтеза, обнаруженного у экстремально галофильных архебактерии, не ясен. Большинство исследователей считают, что этот тип фотосинтеза — сформированное в "кислородную эпоху" приспособление к существованию в условиях недостатка O2. В то же время нельзя полностью исключить возможность сохранения древней формы фотосинтеза, основанного на светозависимых превращениях каротиноидных пигментов.
МЕТАНОБРАЗУЮЩИЕ БАКТЕРИИ
Предположение о биологической природе образования метана было высказано еще в XIX в. Однако изучение этого процесса и организмов, его осуществляющих, тормозилось из-за отсутствия чистых культур. Сложность заключается в чрезвычайной чувствительности большинства метанобразующих бактерий к O2. Быстрый прогресс в изучении этой группы архебактерии связан с использованием методов культивирования анаэробов, разработанных Р. Е. Хангейтом (R. Е. Hungate). В качестве основных приемов используется удаление O2 из газов, в атмосфере которых осуществляется культивирование и все необходимые для работы операции, а также применение предварительно восстановленных сред.
Общая характеристика. Метанобразующие бактерии (метаногены) — морфологически разнообразная группа, объединяемая двумя общими для всех ее представителей признаками: облигатным анаэробиозом и способностью образовывать метан. Для создания таксономической структуры метанобразующих бактерий был использован филогенетический подход, основанный на сравнительном анализе нуклеотидных последовательностей 16S рРНК. В соответствии с таким подходом в IX издании Определителя бактерий Берги группа разделена на три порядка (Methanobacteriales, Methanococcales, Methanomicrobiales), коэффициент сходства (SAB) для которых составляет 0,2 — 0,28. Далее порядки разделены на 6 семейств (SAB = 0,34–0,36) и 13 родов (SAB = 0,46–0,51). Число видов достигает более 40. SAB для них колеблется в пределах 0,55–0,65. О гетерогенности группы можно судить и по нуклеотидному составу ДНК ее представителей (молярное содержание ГЦ-оснований — от 27 до 61%).
В состав группы входят бактерии с разной морфологией: прямые или изогнутые палочки разной длины; клетки неправильной формы, близкие к коккам; извитые формы. У некоторых видов наблюдается тенденция формировать нити или пакеты. Клетки неподвижные или передвигающиеся с помощью перитрихиально или полярно расположенных жгутиков. У представителей рода Methanosarcina в клетках найдены газовые вакуоли. Для некоторых метаногенов характерна развитая система внутриклеточных элементарных мембран, являющихся результатом разрастания и впячивания в цитоплазму ЦПМ и сохраняющих с ней связь. У этой группы архебактерии обнаружены клеточные стенки трех типов: состоящие из псевдомуреина, построенные из белковых глобул и гетерополисахаридной природы. Недавно описан микоплазмоподобный метаноген, выделенный в род Methanoplasma, не имеющий клеточной стенки и фильтрующийся через мембранные фильтры с диаметром пор 0,45 мкм.
20 — 30% мембранных липидов метаногенов представлены нейтральными и 70–80% — полярными липидами. Последние — это в основном два типа простых эфиров глицерина и терпеноидных спиртов (C20-фитаниловый и C40-бифитаниловый), на основе которых образуются полярные фосфо- и гликолипиды (см. рис. 14 и 102). В зависимости от вида клеточные мембраны могут содержать оба типа эфиров или только один. Основными нейтральными липидами являются C20-, C25- и C30-ациклические изопреноидные углеводороды, насыщенные или содержащие двойные связи. Запасных продуктов в виде поли-b-оксимасляной кислоты или гликогена в клетках не обнаружено.
Метанобразующие бактерии — строгие анаэробы. Первые исследования чистых культур, выделенных из рубца жвачных животных, показали, что рост их возможен при начальном окислительно-восстановительном потенциале среды ниже — 300 мВ. Рост некоторых видов полностью подавляется при содержании в газовой фазе более 0,004% молекулярного кислорода. В последнее время, однако, описаны виды с относительно низкой чувствительностью к O2. В их клетках найдена супероксиддисмутаза. Возможно, в природе такие виды могут сохранять жизнеспособность при кратковременных контактах с O2 и возобновлять рост в анаэробных условиях.
Большинство метанобразующих бактерий имеют температурный оптимум для роста в области 30–40°, т. е. являются мезофилами, но есть виды, у которых оптимальная зона сдвинута в сторону более низких (25°) или высоких (55–65°) температур. Недавно выделен экстремально термофильный организм Methanothermus fervidus, растущий при 55–97° (оптимум 80°). Все известные представители этой группы — нейтрофилы с оптимальным pH в области 6,5–7,5. Среди метаногенов есть галофилы, требующие в качестве одного из оптимальных условий для роста содержания в среде до 65–70 г/л NaCl.
В качестве источника углерода и энергии для роста мета-ногены используют узкий круг соединений. Наиболее универсальными источниками углерода и энергии для них является газовая смесь H2 и CO2. Более 3/4 известных видов утилизируют H2 + CO2. Некоторые метаногены приспособились к облигатному использованию этих соединений. Следующими по распространенности источниками углерода и энергии служат формиат, ацетат, метанол, метиламины и моноокись углерода.
Около половины изученных видов не нуждаются в каких-либо органических соединениях. Для роста многих культур в атмосфере H2 и CO2 требуется внесение в среду органических веществ, стимулирующих рост или абсолютно для него необходимых. Это могут быть некоторые витамины группы B, ацетат, пируват, сукцинат, отдельные аминокислоты, дрожжевой экстракт или компоненты неизвестного состава, содержащиеся в природных средах обитания. Так, штаммы, выделенные из рубца жвачных животных, нуждаются в добавках рубцовой жидкости. Сложные органические соединения метанобразующие бактерии использовать не могут.
В качестве источника азота метаногены используют аммонийный азот или некоторые аминокислоты. Для ряда видов показана способность к азотфиксации. Источником серы могут служить сульфаты, сульфид или серосодержащие аминокислоты.
Конструктивный метаболизм. Большинство известных метаногенов способны расти хемолитоавтотрофно на смеси CO2 + H2 в качестве единственного источника углерода и энергии. Энергию получают, осуществляя следующую реакцию:
4Н2 + CO2 ® CH4 + 2H2O
Как видно из этого уравнения, CO2 служит не только единственным источником углерода, но и конечным акцептором электронов при окислении H2. Около 90% использованной CO2 восстанавливается до CH4, что сопровождается синтезом АТФ, и только 10% или меньше включается в вещества клеток.
Фиксация CO2 у автотрофных метаногенов происходит по нециклическому ацетил-КоА-пути, функционирующему и у ацетогенных эубактерий (рис. 107, см. также рис. 62). Ключевым промежуточным соединением этого пути является ацетил-КоА, синтезируемый из двух молекул CO2. Метильная и карбоксильная группы молекулы образуются разными путями. Метильная группа возникает при восстановлении молекулы CO2 до уровня метанола, оставаясь при этом всегда связанной с переносчиком. Карбоксильная группа появляется в результате восстановления второй молекулы CO2 до CO, катализируемого CO-дегидрогеназой. Метальные и карбоксильные группы связываются в реакциях трансметилирования и транскарбоксилирования с образованием активированной уксусной кислоты. Процесс осуществляется при участии уникальных ферментов. Из ацетил-КоА, в результате восстановительного карбоксилирования образуется пируват и далее фосфоенолпировиноградная и щавелевоуксусная кислоты (см. табл. 24), которые служат предшественниками аминокислот и сахаров. Пути фиксации CO2 ацетогенными эубактериями и метаногенными архебактериями различаются коферментами и некоторыми частными реакциями.
Экзогенный ацетат в конструктивный метаболизм включается через ацетил-КоА и далее в серии реакций, функционирующих в восстановительном ЦТК (см. рис. 76). Замкнутости цикла препятствует отсутствие изоцитратдегидрогеназы.

|
| Рис. 107. Схема начальных этапов метаболизма CO2 у Мethanobaircteus thermoautotrophicum: X1-COOH — карбоксипроизводное; X1-CHO — формилпроизводное; X2-CH2 — метиленпроизводное; X2-CH3 — метилпроизводное; Ф1 — метилредуктазная система; Ф2 — CO-дегидрогеназа; ФЕП — фосфоенолпировиноградная кислота; ФГК — фосфоглицериновая кислота; ФГА — фосфоглицериновый альдегид; Ф-6-Ф — фруктозо-6-фосфат; ЩУК — щавелевоуксусная кислота; КоМ-S-CH3 — метилкофермент М |
Биосинтез метана. Восстановление CO2 до CH4 требует переноса 8 электронов. Образующиеся на этом пути промежуточные продукты находятся не в свободном состоянии, а остаются связанными с переносчиками. Согласно предложенной модели на первом этапе CO2 связывается с переносчиком углерода, образуя карбоксипроизводное (X1-COOH), которое восстанавливается до формилпроизводного (X1-CHO). Второй этап метаногенеза включает перенос формильной группы на другой переносчик (Х2), который проводит C1-группу через две последовательные восстановительные реакции, приводящие к образованию метилпроизводного (X2-CH3). На уровне образования метиленпроизводного (X2-CH2) в процесс метаногенеза включается экзогенный формальдегид. Соединения, содержащие метильные группы (CH3OH, CH3COOH, CH3NH2 и другие метиламины), подключаются на уровне метилпроизводного. В этой же точке происходит разветвление анаболических и катаболических путей. Функция X2 у метаногенов напоминает функцию тетрагидрофолата у ацетогенных эубактерий (см. рис. 62).
На третьем конечном этапе метаногенеза, наиболее изученном, метильные группы с переносчика поступают на кофермент М (КоМ-SH). Образуется метил-КоМ. Далее следует его восстановление, сопровождающееся распадом комплекса и выделением CH4. Обе реакции катализируются метилредуктазной системой, представляющей сложный мультиферментный комплекс, в состав которого помимо фермента входят кофермент М, фактор F430. Для активности системы необходимы АТФ, ионы Mg2+ и еще не идентифицированные кофакторы.
Кофакторы. У метаногенов обнаружено около 12 необычных кофакторов, участвующих в первичном метаболизме углерода и водорода.
Кофермент М — 2-меркаптоэтансульфоновая кислота:
Наиболее просто устроенный из известных коферментов. Переносчик и донор метильных групп. Служит субстратом для метилредуктазной системы, катализирующей восстановление метил-КоМ до CH4.

|
| Рис. 108. Коферменты и простетические группы метанобразующих архебактерий: А — фактор F420; Б — фактор F430; В — метаноптерин; Г — метанофуран; R1-3 — различные боковые цепи |
Фактор F420 — производное 5-деазафлавина (рис. 108, А). В окисленном состоянии при нейтральном и щелочном значении pH имеет характерный максимум поглощения при 420 нм. Переносчик электронов с низким окислительно-восстановительным потенциалом ( —380 мВ). Вероятно, выполняет функцию акцептора электронов от гидрогеназы.
Фактор F430 — никельсодержащий тетрапиррол (рис. 108, Б); компонент метилредуктазной системы, участвует в восстановлении метильной группы метил-КоМ до CH4.
Метаноптерин (рис. 108, В) участвует в переносе C1-групп в процессе восстановления CO2 до CH4 на уровне метенил-, метилен- и метилпроизводных.
Метанофуран (рис. 108, Г) также участвует в переносе C1-групп в процессе восстановления CO2 до CH4.
Фактор FB необходим для функционирования метилредуктазной системы. Структура пока не установлена.
Определенная роль в процессе метаногенеза принадлежит корриноидам — производным аналогов витамина B12. Их функции связаны с переносом метильных групп. Считают, что метаногены могут при определенных условиях образовывать активные B12-зависимые метилтрансферазы, участвующие в синтезе метана.
Энергетические процессы. Как отмечалось выше, почти все метанобразующие бактерии могут получать энергию за счет окисления H2, сопряженного с восстановлением CO2. Опытами с меченым водородом показано, что H2 в этом процессе служит только донором электронов, а источником протонов в молекуле метана является вода.
Многие виды для получения энергии могут использовать формиат:
4HCOOH ® CH4 + ЗCO2 + 2H2O.
Для некоторых представителей показана способность образовывать метан при использовании метанола:
4CH3OH ® ЗCH4 + CO2 + 2H2O
а также метилированных аминов.
У ряда метаногенов обнаружена способность окислять окись углерода, что также сопровождается синтезом метана:
4CO + 2H2O ® CH4 + ЗCO2.
Наконец, представители нескольких родов могут использовать в качестве источника энергии и углерода ацетат:
Таким образом, акцепторами электронов (а в ряде случаев и донорами, и акцепторами) у метанобразующих бактерий является ряд одноуглеродных соединений (CO2, CO, формиат, метанол, метилированные амины) и единственное двухуглеродное соединение — ацетат.
Механизм энергетических процессов метаногенов еще не расшифрован, но общие принципиальные положения установлены. Ясно, что получение энергии, по крайней мере при окислении H2, сопряженном с восстановлением CO2, связано с функционированием электронтранспортной системы, включающей дегидрогеназы, переносчики электронов и редуктазы, т. е. определенным видом анаэробного дыхания.
Перенос электронов приводит к образованию трансмембранного протонного градиента, разрядка которого с помощью мембранной АТФ-синтазы сопровождается синтезом АТФ. Доказательством получения метанобразующими бактериями энергии в результате окислительного фосфорилирования служит подавление у них образования АТФ при действии разобщителей и ингибиторов АТФазы. Мало, однако, известно об электронных переносчиках. Не изучена организация дыхательной цепи и ее H+-переносящих участков.
В качестве дегидрогеназ идентифицированы гидрогеназа и формиатдегидрогеназа. От H2 перенос электронов катализируется связанной с мембраной гидрогеназой, с которой они акцептируются фактором F420. С последнего электроны поступают на НАДФ+. Вероятно, и восстановленный фактор F420 и НАДФ-H2 служат донорами электронов для восстановительных превращений C1-групп у метаногенов. Окисление формиата также сопряжено с восстановлением фактора F420 и последующим образованием НАДФ-H2.
Долгое время считали, что у метанобразующих бактерий нет электронных переносчиков, типичных для эубактерий, имеющих электронтранспортные цепи. Недавно у Methanosarcina barken найдены ферредоксин Fe3S3-типа и цитохромы типа b и c. Последние обнаружены также у других видов, способных использовать в качестве энергетических субстратов соединения, содержащие метильные группы (метанол, метилированные амины, ацетат). У метаногенов, растущих только на среде, содержащей смесь H2 + CO2 или формиат, цитохромы не найдены. Из хинонов обнаружены g- и a-токоферохиноны; менахинонов нет.
Терминальные этапы катализируются соответствующими ре-дуктазами, из которых наиболее изучена метилредуктазная система. Реакция, катализируемая метилредуктазой, является общей при образовании метана из различных субстратов (CO2, CO, метанол, ацетат), и именно с ней связано получение клеткой энергии. Фермент локализован в мембране, и его функционирование приводит к трансмембранному перемещению протонов. На 1 молекулу образованного метана приходятся 4 транслоцированных H+.
Открыта способность метанобразующих бактерий использовать в качестве конечного акцептора электронов вместо CO2 молекулярную серу. В присутствии S0 и обычных энергетических субстратов (H2 или метанол) наблюдается образование значительного количества H2S при одновременном снижении в 2–10 раз синтеза CH4.
Таким образом, метанобразующие бактерии способны осуществлять энергетический метаболизм хемолито- или хемоорганотрофного типа, сочетая его с конструктивным обменом авто- или гетеротрофного типа.
Экология и роль в природе. Метаболические свойства метанобразующих бактерий (строгий анаэробиоз, зависимость от ограниченного набора ростовых субстратов, и в первую очередь от молекулярного водорода) определяют их распространение в природе. Обычными местами обитания этих бактерий является анаэробная зона разных водоемов, богатых органическими соединениями. Они обнаруживаются в иловых отложениях озер и рек, в болотах и заболоченных почвах, в осадочных слоях морей и океанов. Метанобразующие бактерии — обитатели пищеварительного тракта животных и человека, а также важный компонент микрофлоры рубца жвачных животных.
Так как метаногены используют ограниченный набор субстратов, их распространение в природе тесно связано с развитием образующих эти субстраты микроорганизмов. Совместно с последними метанобразующие бактерии обеспечивают протекание в природе важного крупномасштабного процесса — анаэробного разложения органических соединений, в первую очередь целлюлозы. Выделяют 3 основные стадии анаэробного разложения органического вещества. Первая — определяется деятельностью микроорганизмов с активными гидролитическими ферментами. Они разлагают сложные органические молекулы (белки, липиды, полисахариды) на более простые органические соединения. Вторая стадия связана с активностью водородобразующих бродильщиков, конечными продуктами метаболизма которых являются H2, CO2, CO, низшие жирные кислоты (в первую очередь ацетат) и спирты. Завершают анаэробную деструкцию органического вещества метанобразующие бактерии. Поскольку главным экологическим фактором, определяющим развитие метаногенов, является выделение H2, в природе созданы и существуют ассоциации между водородвыделяющими и метанобразующими бактериями. Примером такой естественной системы могут служить бактериальные ассоциации, обитающие в рубце жвачных животных и обеспечивающие разложение целлюлозы, пектина и других органических субстратов. О масштабности процессов, связанных с деятельностью мета-нобразующих бактерий, свидетельствует тот факт, что более 20% мировых запасов CH4 имеют биогенное происхождение.
Метанобразующие бактерии представляют определенный практический интерес как продуценты витамина B12 и газообразного топлива — метана.
Возможное место в эволюции. Вхождение метаногенов в состав архебактерий указывает на их древнейшее происхождение. Данные о составе атмосферы первобытной Земли позволяют предполагать, что метаногены могли возникнуть около 3–3,5 млрд лет назад. Предшественниками их могли быть первично анаэробные бродильщики, поскольку метаногены обладают более высокоорганизованным механизмом получения энергии по сравнению с брожением. Но последующее уменьшение в биосфере необходимого для них источника энергии — молекулярного водорода — привело к тому, что метаногены оказались эволюционно тупиковой ветвью.
АРХЕБАКТЕРИЙ БЕЗ КЛЕТОЧНОЙ СТЕНКИ
В 1970 г. из каменного угля, подверженного саморазогреванию, изолирован организм, морфологически и цитологически сходный с микоплазмами. Облигатный термофил: оптимальная температура роста — 59°, нижняя и верхняя границы роста — 45 и 62° соответственно. Оптимальная кислотность — pH 1-2. Организм получил название Thermoplasma acidophilum. Хотя отсутствие клеточной стенки сближает его с микоплазмами, данные по 16S рРНК и другие фенотипические признаки указывают на филогенетическую связь с архебактериями.
ЦПМ Т. acidophilum толщиной 5 — 10 нм, построенная преимущественно из фосфо- и гликолипидов, в основе которых лежит бифитаниловый тетраэфир диглицерина, обнаруживает необычайную устойчивость к действию высокой температуры, низкого pH, литических ферментов, детергентов и осмотического шока.
Геном Т. acidophilum — наименьший из всех известных геномов, обнаруженных у свободноживущих прокариот, и составляет примерно 1/3 генома Е. coli.
У Т. acidophilum функционирует модифицированный путь Энтнера — Дудорова катаболизирования сахаров, приводящий к синтезу АТФ в реакциях субстратного фосфорилирования (см. рис. 105). Факультативный аэроб. В клетках обнаружены менахинон, цитохромы типа b, с, d, цитохромоксидаза, что указывает на возможность функционирования электронтранспортной системы. Вопрос о возможности получения энергии этим организмом за счет окислительного фосфорилирования не ясен.
Естественная экологическая ниша термоплазмы не известна. Она легко выделяется из саморазогревающихся антропогенных угольных куч. Есть сообщения о выделении Thermoplasma из горячих источников. Некоторые исследователи рассматривают Т. acidophilum в качестве организма, предки которого приняли участие в создании эукариотной клетки, став ее ядерно-цитоплазматическим компонентом.
АРХЕБАКТЕРИЙ, ВОССТАНАВЛИВАЮЩИЕ СУЛЬФАТЫ
В 1987 г. описана строго анаэробная архебактерия, выделенная в род Archaeoglobus, способная восстанавливать сульфат до H2S в процессе диссимиляционной сульфатредукции. Клетки кокковидной формы окружены клеточной стенкой, построенной из гликопротеиновых субъединиц и окрашивающейся отрицательно по Граму. Экстремальный термофил, верхняя граница роста 92?. Донорами электронов могут служить H2, формиат, лактат, глюкоза, дрожжевой экстракт. Кроме сульфата в качестве конечного акцептора электронов могут использовать сульфит и тиосульфат, но не молекулярную серу.
Особенность Archaeoglobus, привлекшая внимание исследователей, — способность в небольшом количестве образовывать метан Подобно типичным метанобразующим бактериям в клетках Archaeoglobus содержатся фактор F420 и метаноптерин, но не обнаружены кофермент М и фактор F430.
Результаты определения нуклеотидной последовательности 16S рРНК позволяют рассматривать Archaeoglobus как форму, занимающую промежуточное положение между метаногенами и экстремальными термофилами, метаболизм которых связан с восстановлением или окислением молекулярной серы.
ЭКСТРЕМАЛЬНЫЕ ТЕРМОФИЛЫ, МЕТАБОЛИЗИРУЮЩИЕ МОЛЕКУЛЯРНУЮ СЕРУ
В группу входят организмы, составляющие по данным изучения нуклеотидной последовательности 16S рРНК вторую эволюционную ветвь архебактерий. Образующие ее серозависимые архебактерии разнородны в морфологическом, физиологическом и, как следствие этого, систематическом отношении. В IX издании Определителя бактерий Берги они подразделяются на 3 порядка, 4 семейства и включают 9 родов. Однако в литературе описан еще ряд организмов, выделенных в новые роды в рамках этой группы, и список их постоянно растет.
Группа объединяет клетки разной морфологии: кокки, палочки, диски, нити или неправильной дольчатой формы. Клеточные стенки, окрашивающиеся отрицательно по Граму, построены из гликопротеиновых или белковых субъединиц. Мембраны монослойные, содержат липиды, построенные на основе тетраэфиров глицерина. Бифитанильные цепи содержат от 1 до 4 пятичленных циклических группировок.
Источником углерода для роста служат разнообразные органические соединения (белки, пептиды, отдельные аминокислоты, углеводы, кислоты) и CO2. Разные представители в этом плане существенно различаются: большинство — облигатные гетеротрофы, некоторые — факультативные и облигатные автотрофы. Автотрофная ассимиляция CO2 происходит, вероятно, по восстановительному ЦТК. Углеводы, что показано по крайней мере для Sulfolobus, катаболизируются по модифицированному пути Энтнера–Дудорова (см. рис. 105).
Своеобразен энергетический метаболизм экстремально термофильных архебактерий. Он облигатно или факультативно связан с метаболизмом молекулярной серы. Основные способы получения энергии включают аэробное или анаэробное (серное) дыхание, а также брожение (табл. 34). Перечисленные в таблице способы энергетического существования экстремально термофильных архебактерий не исчерпывают всех, описанных к настоящему времени у отдельных представителей.
Наиболее полно в этом отношении изучены представители рода Sulfolobus, входящие в порядок Sulfolobales. Это облигатно или факультативно аэробные организмы. Способны к росту в авто- или гетеротрофных условиях при использовании в качестве источника энергии H2S и/или S0, которые окисляют до H2SO4, понижая pH среды до 1 и ниже. У Sulfolobus и других архебактерий, метаболизирующих молекулярную серу, отсутствует периплазматическое пространство. Окисление S0 происходит, вероятно, на наружной поверхности ЦПМ. Некоторые виды Sulfolobus могут окислять не только S0, но и Fe2+, а также сульфиды металлов. При недостатке O2 могут окислять S0 в анаэробных условиях, используя в качестве конечного акцептора электронов Fe3+ или Mo6+, восстанавливая последний до Mo5+.
Таблица 34. Основные способы получения энергии экстремально термофильными архебактериями
| Источник углерода | Энергетический процесс | Представители рода | ||
| донор электронов | акцептор электронов | энергодающая реакция | ||
| CO2 | H2 | S0 | H2 + S0 ®H2S | Pyrodictium, Thermoproteus, Acidianus |
| S0 | O2 | 2S0 + 3O2 + 2H2O ® 2H2SO4 | Sulfolobus, Acidianus | |
| Органические соединения | (CHO)* | S0 | (CHO) + S0 ® H2S | Thermoproteus, Desulfurococcus, Thermophilus |
| (CHO) | O2 | (CHO) + O2 ® 2H2O | Sulfolobus | |
| (CHO) | (CHO) | дрожжевой экстракт ® ацетат, CO2 и др. соединения | Staphylothermus | |
* (СНО) — органическое соединение.
Для представителей рода Acidianus, близкого к Sulfolobus, обнаружена способность в зависимости от условий метаболизировать молекулярную серу в разных направлениях:
1) окислять H2S и S0 до SO42 – в аэробных условиях;
2) восстанавливать S0 до H2S с помощью H2 в анаэробных условиях.
Облигатно анаэробные формы, отнесенные в порядки Thermococcales и Thermoproteales, используют S0 только в качестве конечного акцептора электронов, восстанавливая ее до H2S. Донорами электронов служат H2 или различные органические соединения. Есть среди представителей этих порядков и облигатные литотрофы, использующие для восстановления S0 только H2 (Pyrodictium).
Восстановление S0 до H2S, сопряженное с окислением H2, связано с получением клеточной энергии. В мембранах Sulfolobus обнаружены цитохромы типа b и a, а также протонзависимая АТФ-синтаза. Показано, что в основе синтеза АТФ лежит хемиосмотический механизм.
Таким образом, отношение к O2 в группе серозависимых архебактерий охватывает диапазон от облигатного аэробиоза до строгого анаэробиоза. Есть и факультативные формы. Облигатно аэробные формы осуществляют окисление S0, строгие анаэробы — только восстановление, факультативные — в зависимости от условий могут окислять или восстанавливать S0.
В составе группы нейтрофилы и ацидофилы. Например, все виды Sulfolobus растут в диапазоне pH от 1 до 6, оптимальная область — 2–3.
Второй признак, объединяющий всех представителей группы, — экстремальная термофилия: нижний температурный предел роста — 60–82°, оптимум — 80–105°, верхняя граница — 95–110°. Pyrodictium occultum, один из представителей серозависимых архебактерий, обладает самым высоким температурным пределом роста из всех известных прокариот. Он способен расти при 110°, с оптимумом при 105°. На среде с молекулярной серой дисковидные клетки Р. occultum образуют нитевидные выросты диаметром примерно 20 нм, формирующие плотную сеть (отсюда и название архебактерий переводится как "огненная сеть"). Нити, представляющие собой полые цилиндры, состоящие из спирально упакованных единиц, обеспечивают фиксацию клеток на гранулах серы.
Химические и биохимические основы термофилии пока не установлены, но для экстремально термофильных архебактерий (также как и аналогичных эубактерий) показана исключительная термостабильность ряда ферментов и особое строение клеточных стенок, мембран и липидов. Поскольку оптимальная температура роста многих экстремальных термофилов превышает температуру плавления их очищенной ДНК, возникает вопрос о механизмах поддержания у них стабильности двойной спирали ДНК. В клетках экстремальных термофилов обнаружены разнообразные белки, связывающиеся с ДНК и повышающие ее температуру плавления. Для заметной стабилизации ДНК соотношение между белком и ДНК должно быть 10–15:1. При таких соотношениях вся ДНК находится в клетке в виде комплекса с белками и имеет температуру плавления, близкую к максимальной температуре роста организма.
Экстремально термофильные архебактерий с оптимумом роста 80° и выше обнаруживаются только в горячих источниках и грунтах в зонах вулканической активности. Наиболее высокотемпературные представители рода Pyrodictium выделяют из подводных морских горячих источников. Развиваясь интенсивно в этих зонах, богатых, как правило, серой и сульфидами, серозависимые архебактерий проявляют активную геохимическую деятельность. В условиях высоких температур они могут быть виновниками активных процессов биокоррозии стали. Хемолитотрофные виды перспективны для использования в биогидрометаллургии, а также для обессеривания некондиционного каменного угля.
М.В.Гусев, Л.А.Минеева © 1992-2001
Кафедра клеточной физиологии и иммунологии биологического факультета МГУ им. М.В.Ломоносова © 2000-2001
Страница обновлена 09.09.01
Оформление: А.В.Киташов