ГЛАВА 16. ДЫХАНИЕ. ТИПЫ ЖИЗНИ, ОСНОВАННЫЕ НА ОКИСЛИТЕЛЬНОМ ФОСФОРИЛИРОВАНИИ
Чтобы максимально использовать энергетические возможности, заложенные в процессе переноса электронов от субстрата на молекулярный кислород, необходимо было сформировать. механизмы, позволяющие полностью отщеплять водород (электроны) от субстрата; создать системы, в которых весь отщепленный водород передается на O2 наиболее рациональным путем, образовать механизмы, при помощи которых энергия электронного переноса трансформируется в химическую энергию, доступную для использования во всех энергозависимых процессах клетки. В ходе эволюции эти задачи были решены следующим образом.
- Полное отщепление водорода от органического субстрата достигается в результате функционирования ЦТК или окислительного пентозофосфатного цикла. Если энергетическим субстратом являются неорганические соединения, для их окисления также были сформированы ферментативные реакции, катализируемые соответствующими дегидрогеназами.
- Перенос водорода на молекулярный кислород осуществляется с помощью системы структурно и функционально взаимосвязанных переносчиков, составляющих в совокупности "дыхательную цепь".
- Энергетические возможности переноса электронов по электрохимическому градиенту реализуются в результате функционирования механизмов, сопрягающих электронный транспорт с фосфорилированием.
Рассмотрим подробнее, как была решена каждая задача, при этом нам представляется более удобным сначала изложить максимум того, что достигнуто природой в процессе эволюции, а уже затем — какие варианты на пути формирования аналогичных механизмов обнаружены у эубактерий.
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
ЦТК можно рассматривать как выработанный клеткой механизм, имеющий двоякое назначение. Основная функция его заключается в том, что это совершенный клеточный "котел", в котором осуществляется полное окисление вовлекаемого в него органического субстрата и отщепление водорода. Другая функция цикла — снабжение клетки рядом предшественников для биосинтетических процессов. Обычно ЦТК является дальнейшей "надстройкой" над анаэробными энергетическими механизмами клетки. Исходным субстратом ЦТК служит ацетил-КоА ("активированная уксусная кислота"), образующийся у аэробов из пирувата в реакции, осуществляемой пируватдегидрогеназным комплексом:
CH3-CO-COOH + КоA-SH + НАД+ ® CH3-CO~S-КоA + НАД-H2 + CO2
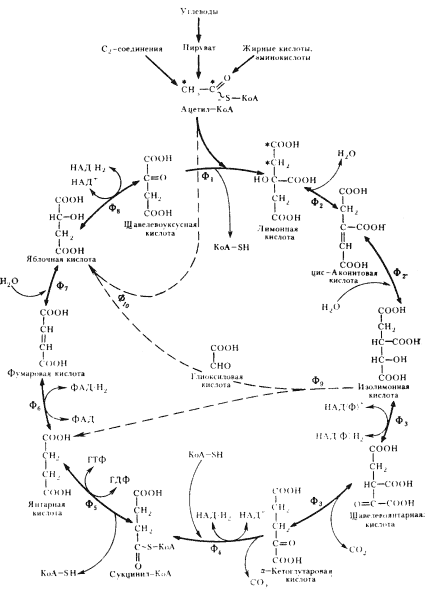
|
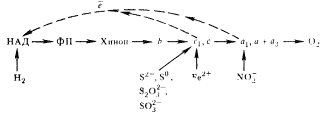
| Рис. 92. Цикл трикарбоновых кислот и глиоксилатный шунт: Ф1 — цитратсинтаза (конденсирующий фермент); Ф2 — аконитаза; Ф3 — изоцитратдегидрогеназа; Ф4 — a-кетоглутаратдегидрогеназа; Ф5 — сукцинилтиокиназа; Ф6 — сукцинатдегидрогеназа; Ф7 — фумараза; Ф8 — малатдегидрогеназа; Ф9 — изоцитратлиаза; Ф10 — малатсинтетаза. Включение углеродных атомов ацетильного остатка в молекулу лимонной кислоты помечено звездочками. Пунктирными линиями изображены реакции глиоксилатного шунта |
Собственно ЦТК (рис. 92) начинается с конденсации ацетил-КоА с молекулой щавелевоуксусной кислоты, катализируемой цитратсинтазой. Продуктами реакции являются лимонная кислота и свободный кофермент А. Лимонная кислота с помощью фермента аконитазы последовательно превращается в цис-аконитовую и изолимонную кислоты. Последняя превращается в a-кетоглутаровую кислоту в реакции, катализируемой изоцитратдегидрогеназой. H2 первом этапе реакции имеет место дегидрирование изолимонной кислоты, в результате которого образуется щавелевоянтарная кислота и НАД-H2. На втором этапе щавелевоянтарная кислота, все еще, вероятно, связанная с ферментом, подвергается декарбоксилированию. Продукты реакции — a-кетоглутаровая кислота, освобождающаяся от фермента, и CO2.
a-кетоглутаровая кислота подвергается далее окислительному декарбоксилированию, катализируемому a-кетоглутаратдегидрогеназным комплексом, в результате чего образуется сукцинил-КоА. Эта реакция — единственная необратимая реакция из десяти, составляющих ЦТК. Один из продуктов реакции — сукцинил-КоА — представляет собой соединение, содержащее высокоэнергетическую тиоэфирную связь.
Следующий этап — образование янтарной кислоты из сукцинил-КоА, катализируемое сукцинилтиокиназой, в результате которого энергия, освобождающаяся при разрыве тиоэфирной связи, запасается в фосфатной связи ГТФ. ГТФ затем отдает свою фосфатную группу молекуле АДФ, что приводит к образованию АТФ. Следовательно, на данном этапе ЦТК имеет место субстратное фосфорилирование.
Янтарная кислота окисляется в фумаровую с помощью фермента сукцинатдегидрогеназы. Далее фумаровая кислота гид-ратируется под действием фумаразы, в результате чего возникает яблочная кислота, которая подвергается дегидрированию, приводящему к образованию ЩУК. Реакция катализируется НАД-зависимой малатдегидрогеназой. Этой реакцией завершается ЦТК, так как вновь регенерируется молекула-акцептор (ЩУК), запускающая следующий оборот цикла. Однако поскольку из цикла происходит постоянный отток для биосинтезов промежуточных метаболитов, приводящий к понижению уровня ЩУК, возникает необходимость в ее дополнительном синтезе. Это обеспечивается как в реакциях карбоксилирования пирувата или фосфоенолпирувата (см. табл. 24), так и с помощью последовательности из двух реакций, получивших название глиоксилатного шунта (рис. 92). В первой из них изолимонная кислота под действием изоцитратлиазы расщепляется на янтарную и глиоксиловую кислоты. Во второй реакции, катализируемой малатсинтетазой, глиоксиловая кислота конденсируется с ацетил-КоА с образованием яблочной кислоты, превращающейся далее в ЩУК. В результате двух новых реакций происходит синтез C4-кислоты из двух C2-остатков. Глиоксилатный шунт не работает при выращивании на субстратах, катаболизирование которых приводит к образованию пировиног-радной кислоты. Он включается при выращивании организмов на C2-соединениях.
Энергетическим "топливом", перерабатываемым в ЦТК, служат не только углеводы, но и жирные кислоты (после предварительной деградации до ацетил-КоА), а также многие аминокислоты (после удаления аминогруппы в реакциях дезамини-рования или переаминирования). В результате одного оборота цикла происходят 2 декарбоксилирования, 4 дегидрирования и 1 фосфорилирование. Итогом 2 декарбоксилирований является выведение из цикла 2 атомов углерода (2 молекулы CO2), т. е. ровно столько, сколько его поступило в виде ацетильной группы. В результате 4 дегидрировании образуются 3 молекулы НАД-H2 и 1 молекула ФАД-H2. Как можно видеть, в процессе описанных выше превращений весь водород оказывается на определенных переносчиках и задача теперь — передать его через другие переносчики на молекулярный кислород.
Как представлено это у эубактерий? С определенными последовательностями ферментативных реакций, аналогичных тем, которые имеют место в ЦТК, мы встречаемся у эубактерий, находящихся на разных этапах эволюционного развития. Некоторые реакции цикла функционируют в анаэробных условиях у бактерий, получающих энергию в процессах брожения.
У пропионовых бактерий в последовательность реакций брожения, ведущих к синтезу пропионовой кислоты, "вмонтированы" реакции от янтарной кислоты до ЩУК, аналогичные таковым ЦТК, но идущие в противоположном направлении и связанные на двух этапах с восстановлением субстратов реакций (см. рис. 54). В пропионовокислом брожении эти реакции функционируют для акцептирования водорода, являясь одним из вариантов решения донор-акцепторной проблемы в анаэробных условиях.
У других эубактерий мы встречаемся с более полно сформированной последовательностью реакций, аналогичных ЦТК, но еще не замкнутых в полный цикл. Наиболее часто отсутствует ферментативный этап превращения a-кетоглутаровой кислоты в янтарную, в результате чего ЦТК представляется как бы "разорванным" (см. рис. 85). "Разорванный" ЦТК обнаружен у бактерий, осуществляющих бескислородный фотосинтез, цианобактерий, хемоавтотрофов и у некоторых хемогетеротрофов. Вероятно, в таком виде ЦТК не может функционировать в системе энергодающих механизмов клетки. В этом случае его основная функция — биосинтетическая. Тот факт, что "разорванный" ЦТК встречается у различных далеко отстоящих друг от друга физиологических групп эубактерий, указывает на сложные пути эволюции данного механизма. Этот вопрос требует своего объяснения.
ДЫХАТЕЛЬНАЯ ЦЕПЬ
Электроны с восстановленных переносчиков (НАД-H2, НАДФ-H2, ФАД-H2), образующихся при функционировании ЦТК или окислительного пентозофосфатного цикла, поступают в дыхательную цепь, где проходят через ряд этапов, опускаясь постепенно на все более низкие энергетические уровни, и акцептируются соединением, служащим конечным акцептором электронов. Перенос электронов приводит к значительному изменению свободной энергии в системе. В наиболее совершенном виде и единообразии дыхательная цепь предстает у эукариот, где она локализована во внутренней мембране митохондрий. У эубактерий дыхательные цепи поражают разнообразием своей конкретной организации при сохранении принципиального сходства в строении и функционировании.
Дыхательные электронтранспортные цепи состоят из большого числа локализованных в мембране переносчиков, с помощью которых электроны передаются или вместе с протонами, т. е. в виде атомов водорода, или без них. Компонентами цепи, локализованными в мембране, являются переносчики белковой (флавопротеины, FeS-белки, цитохромы) или небелковой (хиноны) природы. Флавопротеины и хиноны осуществляют перенос атомов водорода, а FeS-белки и цитохромы — электронов.
НАД(Ф)-зависимые дегидрогеназы, катализирующие отрыв водорода от молекул различных субстратов и передающие его на стартовый переносчик дыхательной цепи — НАД(Ф)-H2-дегидрогеназу, — растворимые ферменты. Дегидрогеназы флавопротеиновой природы, выполняющие аналогичную функцию, могут быть локализованными в мембране (например, сукцинатдегидрогеназа) или существовать в растворимой форме (ацетил-КоА-дегидрогеназы жирных кислот). Водород с них поступает в дыхательную цепь на уровне хинонов.
Известно более 250 НАД(Ф)-зависимых дегидрогеназ, активно участвующих в реакциях промежуточного обмена. Но не все из них имеют отношение к энергетическому метаболизму. С помощью дегидрогеназ осуществляется перенос гидрид-иона (2e– + Н+ ® H–) от субстрата к НАД(Ф), при этом в среду переходит протон (рис. 93, А). Атом водорода входит в состав пиридинового кольца, а электрон присоединяется к азоту пиридинового кольца. После восстановления НАД(Ф)-H2 отщепляется от активного центра фермента и переносится к мембране, где акцептируется флавиновой дегидрогеназой и передает ей восстановительные эквиваленты. Одновременно к дегидрогеназе, освобожденной от кофермента, присоединяется окисленная молекула НАД(Ф), поступающая из среды. Таким образом, особенность НАД(Ф) — их подвижность, позволяющая им курсировать от молекул — доноров электронов, находящихся в цитоплазме, к акцепторам электронов, локализованным в мембране.
В состав флавиновых дегидрогеназ входят флавиновые нуклеотиды, прочно связанные с апоферментом и не отщепляющиеся от него ни на одной стадии каталитического цикла. Окислительно-восстановительные свойства флавопротеинов обусловлены способностью изоаллоксазинового кольца рибофлавина к обратимому переходу из окисленного состояния в восстановленное, при котором происходит присоединение к кольцу 2 электронов в составе атомов водорода (рис. 93, Б). При изучении дыхательных цепей особенно интересны два связанных с мембраной флавопротеина: сукцинатдегидрогеназа, катализирующая окисление сукцината в ЦТК, и НАД(Ф)-H2-дегидрогеназа, катализирующая восстановление своей флавиновой простетической группы, сопряженное с окислением НАД(Ф)xH2.
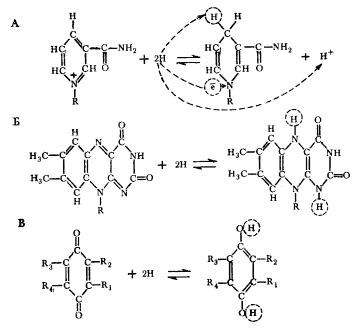
|
| Рис. 93. Механизмы обратимого окисления и восстановления некоторых переносчиков водорода: А — пиридиновое кольцо НАД(Ф); Б — изоаллоксазиновое кольцо рибофлавина ФМН или ФАД; В — хиноидное кольцо. Присоединенные атомы водорода и электрон пиридинового кольца обведены пунктиром (по Dagley, Nicholson, 1973) |
Участие в дыхательном электронном транспорте принимают белки, содержащие железосероцентры (см. рис. 58). Они входят в состав некоторых флавопротеинов, например сукцинат- и НАД(Ф)-H2-дегидрогеназ, или же служат в качестве единственных простетических групп белков. Дыхательные цепи содержат большое число FeS-центров. В митохондриальной электронтранспортной цепи функционирует, вероятно, около дюжины таких белков. В зависимости от строения FeS-центры могут осуществлять одновременный перенос 1 или 2 электронов, что связано с изменением валентности атомов железа.
Хиноны — жирорастворимые соединения, имеющие длинный терпеноидный "хвост", связанный с хиноидным ядром, способным к обратимому окислению — восстановлению путем присоединения 2 атомов водорода (рис. 93, В). Наиболее распространен убихинон, функционирующий в дыхательной цепи на участке между флавопротеинами и цитохромами. В отличие от остальных электронных переносчиков хиноны не связаны со специфическими белками. Небольшой фонд убихинона растворен в липидной фазе мембран.
Цитохромы, принимающие участие на заключительном этапе цепи переноса электронов, представляют собой группу белков, содержащих железопорфириновые простетические группы (гемы). С помощью цитохромов осуществляется перенос электронов, в процессе которого меняется валентность железа:
Fe2+ « Fe3+ + e–
В митохондриях обнаружено пять цитохромов (b, c, c1, a, a3), различающихся между собой спектрами поглощения и окислительно-восстановительными потенциалами. Различия по этим параметрам обусловлены белковыми компонентами цитохромов, природой боковых цепей их порфиринов и способом присоединения гема к белкам. Конечные цитохромы (a + a3) передают электроны на молекулярный кислород, представляя собой собственно цитохромоксидазу, в реакционном центре которой содержатся помимо двух гемов два атома меди. Образование воды имеет место при переносе на молекулу кислорода 4 электронов. Некоторые цитохромоксидазы осуществляют перенос на O2 только 2 электронов, следствием чего является возникновение перекиси водорода. Перекись водорода далее разрушается каталазой или пероксидазой.
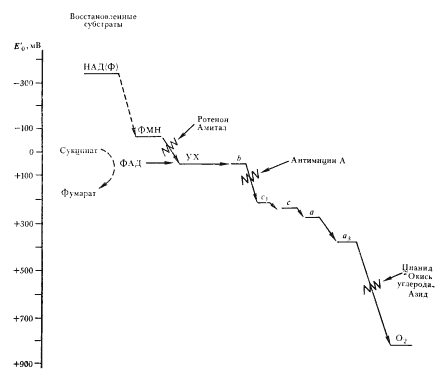
|
| Рис. 94. Схема переноса электронов в дыхательной цепи митохондрий: ФМН — простетическая группа НАД(Ф)-H2 — дегидрогеназы; ФАД — простетическая группа сукцинатдегидрогеназы; УХ — убихинон; b, c, с1, а, a3 — цитохромы. Сплошными линиями обозначены процессы, протекающие в мембране; прерывистыми — в цитозоле клетки; зигзагообразной линией показаны места действия ингибиторов |
Таким образом, дыхательная цепь переноса электронов в митохондриях состоит из большого числа промежуточных переносчиков, осуществляющих электронный транспорт с органических субстратов на O2. Последовательность их расположения, представленная на рис. 94, подтверждается различного рода данными: значениями окислительно-восстановительных потенциалов переносчиков, ингибиторным анализом.
Обнаружены ингибиторы, специфически действующие на определенные участки дыхательной цепи. Амитал и ротенон блокируют перенос электронов на участке до цитохрома b, действуя предположительно на НАД(Ф)-H2-дегидрогеназу. Антимицин А (антибиотик, продуцируемый Streptomyces) подавляет перенос электронов от цитохрома b к цитохрому c1. Цианид, окись углерода и азид блокируют конечный этап переноса электронов от цитохромов a + a3 на молекулярный кислород, ингибируя цитохромоксидазу. Если блокировать перенос электронов в электронтранспортной цепи определенными ингибиторами, то переносчики, находящиеся на участке от субстрата до места действия ингибитора, будут в восстановленной, а переносчики за местом действия ингибитора — в окисленной форме.

|
| Рис. 95. Дыхательные цепи Azotobacter vinelandii (A). Micrococcus lysodeikticus (Б) и Escherichia coli (В) в аэробных (1), микроаэробных (2) и анаэробных (3) условиях: ФП — флавопротеин; FeS — железосероцентр; УХ — убихинон; MX — менахинон; ФР — фумаратредуктаза; b, c, c1, a, a3 — цитохромы |
Какие формы организации дыхательной цепи обнаружены у эубактерий, т. е. на определенных подступах к ее окончательному формированию? Группы первично анаэробных хемогетеротрофов не имеют развитой системы связанного с мембранами электронного транспорта. Полностью сформированной системой дыхательного электронного транспорта обладают фотосинтезирующие эубактерии: цианобактерии, многие пурпурные бактерии (в наибольшей степени дыхание развито у несерных пурпурных бактерий). Все облигатно и факультативно аэробные хемотрофы имеют дыхательные цепи. У разных групп эубактерий они значительно различаются по составу, что выражается в следующем: замене одних переносчиков другими со сходными свойствами (убихинон — менахинон, цитохромы aa3 — o и т. д.); добавлении или удалении какого-либо переносчика (например, цитохрома c); разветвлении на уровне первичных дегидрогеназ, являющемся результатом множества мест включения восстановительных эквивалентов с окисляемых субстратов в цепь, и ветвлении, связанном с присутствием 2 или более цитохромоксидаз. Дыхательные цепи некоторых хемогетеротрофных эубактерий приведены на рис. 95.
ЗАПАСАНИЕ КЛЕТОЧНОЙ ЭНЕРГИИ В ПРОЦЕССЕ ДЫХАНИЯ
Вся система переноса электронов от субстрата на O2 через длинную цепь переносчиков представлялась бы нерационально громоздкой, если бы единственной целью процесса было соединение электронов с молекулярным кислородом. Другое назначение этого механизма состоит в запасании освобождающейся в процессе электронного переноса энергии путем трансформирования ее в химическую энергию фосфатных связей.
Имеющиеся экспериментальные данные подтверждают выдвинутый в начале 60-х гг. английским биохимиком П. Митчеллом хемиосмотический механизм энергетического сопряжения электронного транспорта с фосфорилированием. П. Митчелл "обратил внимание" на судьбу протонов при электронном транспорте, которые переносятся в этом процессе через мембрану в одном направлении, создавая градиент концентрации H+ по обе стороны мембраны (см. рис. 25). Перенос электронов и протонов обеспечивается определенным сорасположением мембранных переносчиков, а также свойствами самой мембраны, в первую очередь ее непроницаемостью для протонов.
В митохондриях на 3 участках окислительной цепи происходит выделение протонов во внешнюю среду. Соответственно 3 реакции ведут к образованию DmH+ (рис. 96). Первая локализована в начале дыхательной цепи и связана с функционированием НАД(Ф)-H2-дегидрогеназы. Второй генератор DmH+ определяется способностью убихинона переносить водород. Последний локализован в конце дыхательной цепи и связан с активностью цитохромоксидазы.
Поскольку синтез молекулы АТФ связан, как минимум, с переносом 2 протонов через АТФ-синтазу, а при окислении НАД(Ф)-H2 молекулярным кислородом, т. е. поступлении 2 электронов на 1/2O2 выделяются 6H+, максимальный выход АТФ в этом .процессе составляет 3 молекулы. Для количественной оценки эффективности фосфорилирования при переносе электронов используют отношение P/O, означающее количество потребленных молекул неорганического фосфата, приходящихся на 1 поглощенный атом кислорода. H2 препаратах изолированных митохондрий показано, что при переносе водорода от изолимонной или яблочной кислот на НАД+, а затем на молекуляроный кислород отношение P/O равно 3. Приокислении янтарной кислоты, водород которой переносится на сукцинатдегидрогеназу и далее на убихинон, возможны только 2 фосфорилирования, так как при этом выпадает участок дыхательной цепи, где локализован первый генератор DmH+. Таким образом, место включения электронов от разных субстратов в цепь их дальнейшего транспорта определяет число функционирующих протонных помп в дыхательной цепи.
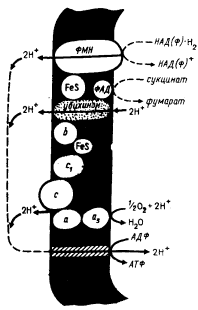
|
| Рис. 96. Топография компонентов дыхательной цепи митохондрий: ФМН — простетическая группа НАД(Ф)-H2-дегидрогеназы; ФАД — простетическая группа сукцинатдегидрогеназы; FeS — железхеросолержащий белок; b, c1, c, a, a3 — цитохромы. |
Теперь можно подвести итог тому, каков энергетический выход при окислении молекулы глюкозы, осуществляемом в максимально отлаженной энергетической системе, функционирующей в эукариотных клетках: гликолиз ® ЦТК ® дыхательная цепь митохондрий. H2 первом этапе в процессе гликолитичес-кого разложения молекулы глюкозы образуются по 2 молекулы пирувата, АТФ и НАД-H2. Конечными продуктами реакции окислительного декарбоксилирования 2 молекул пирувата, катализируемой пируватдегидрогеназным комплексом, являются 2 молекулы ацетил-КоА и НАД-H2. Окисление 2 молекул ацетил-КоА в ЦТК приводит к образованию 6 молекул НАД-H2 и по 2 молекулы ФАД-H2 и АТФ. Перенос каждой пары электронов с НАД-H2, если принять P/O равным 3, приводит к синтезу 30 молекул АТФ (2 молекулы НАД-H2 дает процесс гликолиза, 2 молекулы НАД-H2 — окислительное декарбоксилирование пирувата, 6 молекул НАД-H2 — ЦТК). Перенос каждой пары электронов с ФАД-H2 приводит к синтезу 2 молекул АТФ, т. е. при двух оборотах цикла это дает 4 молекулы АТФ. К этому следует прибавить 2 молекулы АТФ, образуемые в процессе гликолиза, и 2 молекулы АТФ, синтезируемые в ЦТК на этапе превращения сукцинил-КоА в янтарную кислоту. Итак, полное окисление 1 молекулы глюкозы в максимальном варианте приводит к образованию 38 молекул АТФ.
Для аэробных эубактерий характерна меньшая степень сопряжения электронного транспорта в дыхательной цепи с фосфорилированием, проявляющаяся в низком значении коэффициента Р/O. В опытах, проводившихся с использованием препаратов бактериальных мембран, это отношение в большинстве случаев не превышало 1. Невысокое значение Р/O связано с тем, что в бактериальных дыхательных цепях локализовано меньше генераторов DmH+, чем в митохондриальной дыхательной цепи. Нельзя также исключать и то обстоятельство, что в процессе получения препаратов бактериальных мембран нарушается их структурная целостность, а это приводит к резкому падению функциональной активности выделенных мембран. У Е. coil и Azotobacter vinelandii отношение P/O равно 2, у Corynebacterium diphteriae — 1, а у Mycobacterium phlei — 3. Это позволяет сделать вывод о том, что дыхательные цепи бактерий весьма существенно отличаются от аналогичной системы, функционирующей в эукариотных клетках. Они менее стабильны по составу и значительно менее энергетически эффективны.
Все эубактерий, имеющие развитую систему электронного транспорта, сопряженного с генерированием энергии, можно разделить на две большие группы в зависимости от источника энергии, т. е. природы донора электронов. К первой группе относятся организмы, использующие в качестве источника энергии процессы окисления неорганических соединений. Вторую группу составляют организмы, у которых донорами электронов служат различные органические соединения.
Таблица 29. Типы анаэробного дыхания у эубактерий*
| Энергетический процесс | Конечный акцептор электронов | Продукты восстановления |
| Нитратное дыхание и денитрификация | NO3–, NO2– | NO2–, NO, N2O, N2 |
| Сульфатное и серное дыхание | SO42–, S0 | H2S |
| Карбонатное дыхание | CO2 | ацетат |
| Фумаратное дыхание | фумарат | сукцинат |
* Описаны анаэробные бактерии, способные окислять органические соединения, используя в качестве конечного акцептора электронов Fe3+ или Mn4+.
Вместо O2 некоторые эубактерий могут в качестве конечного акцептора электронов использовать ряд окисленных органических или неорганических соединений (табл. 29). Этот процесс получил название анаэробного дыхания. Освобождаемая энергия и состав переносчиков определяются окислительно-восстановительными потенциалами акцепторов электронов. Анаэробные дыхательные цепи содержат те же типы переносчиков, что и аэробные, но цитохромоксидазы заменены соответствующими редуктазами. Иные, нежели O2, акцепторы электронов могут использоваться в этом качестве только в отсутствие молекулярного кислорода в среде или же последний вообще не может служить акцептором электронов. В зависимости от этого эубактерий, осуществляющие анаэробное дыхание, относятся к факультативным или облигатным анаэробам. Донорами электронов у них могут служить органические или неорганические соединения.
ГРУППЫ ХЕМОЛИТОТРОФНЫХ ЭУБАКТЕРИЙ
Эубактерий, у которых источником энергии служат процессы окисления неорганических соединений, были обнаружены в конце XIX в. и их открытие связано с именем С. Н. Виноградского. В качестве источников энергии хемолитотрофы могут использовать довольно широкий круг неорганических соединений, окисляя их при дыхании (табл. 30). Дыхательные цепи хемолитотрофов содержат те же типы переносчиков, что и хемоорганотрофов. Разнообразие наблюдается только на периферических участках энергетического метаболизма, так как для окисления неорганических соединений, связанного с получением энергии, необходимы соответствующие ферментные системы. Например, у Thiobacillus ferrooxidans, получающего энергию в результате окисления двухвалентного железа, дыхательная цепь дополнена медьсодержащим белком рустицианином, непосредственно акцептирующим электроны с Fe2+.
Таблица 30. Группы хемолитотрофных эубактерий*
| Группа эубактерий | Характеристика энергетического процесса | Способность к автотрофии | ||
| донор электронов | акцептор электронов | конечные продукты** | ||
| Тионовые бактерии | H2S, S0, SO32–, S2O32– и др. | O2 | SO42– | + |
| NO3– | SO42–, NO2–, N2 | |||
| Ацидофильные железобактерии | Fe2+ | O2 | Fe3+ | + |
| Нитрифицирующие бактерии | NH4+ | O2 | NO2– | + |
| NO2– | NO3– | |||
| Водородные бактерии | H2 | O2 | H2O | + |
| NO3–, NO2– | H2O, NO2–, N2 | |||
| Карбоксидобактерии | CO | O2 | CO2 | + |
| Сульфатвосстанавливающие бактерии | H2 | SO42– | H2S | *** |
* Описана автотрофная бактерия Stibiobacter senarmontii, источником энергии для которой служит окисление трехвалентной сурьмы до пятивалентной.
** Если акцептор электронов O2, одним из конечных продуктов является вода.
*** У отдельных представителей. Используемые в качестве доноров электронов неорганические соединения различаются окислительно-восстановительными потенциалами. Это определяет место включения в дыхательную цепь электронов окисляемого субстрата. При окислении H2 водородными бактериями электроны с субстрата включаются в дыхательную цепь на уровне НАД+, при окислении Fe2+ железобактериями — на уровне цитохрома c, а при окислении NO2 – нитрификаторами — на уровне цитохрома a, (рис. 97). В целом окисление эубактериями неорганических соединений (за исключением H2) сопряжено с переносом электронов на цитохромы. С этим связаны важные последствия. Включение электронов с субстрата на уровне цитохромов приводит к тому, что во-первых, в электронтранспортной цепи функционирует только один генератор DmH+, поэтому для обеспечения энергией организму необходимо "переработать" большое количество энергетического субстрата; во-вторых, в этом процессе не образуется восстановитель НАД-H2, необходимый для биосинтетических процессов. Потребность в НАД-H2 особенно высока, если источником углерода служит CO2.
Природа остроумно решила эту проблему ценой дополнительных энергетических затрат: в тех случаях, когда место включения электронов с окисляемого субстрата находится ниже энергетического уровня, на котором образуется НАД-H2, работает система обратного переноса электронов, т. е. "лифт", поднимающий электроны по дыхательной цепочке в сторону более отрицательного потенциала, необходимого для восстановления молекул НАД+. Процесс обратного транспорта электронов требует энергии, и часть молекул АТФ, получаемых за счет окислительного фосфорилирования на конечном этапе дыхательной цепи, тратится для образования восстановителя. Окисление соединений с положительным окислительно-восстановительным потенциалом происходит, таким образом, без участия флавопротеинов и хинонов. Эти переносчики функционируют только в процессе обратного переноса электронов. Следовательно, у таких эубактерий дыхательная цепь работает в двух направлениях: осуществляет транспорт электронов для получения энергии в соответствии с термодинамическим потенциалом и перенос электронов против термодинамического потенциала, идущий с затратой энергии, чтобы синтезировать восстановитель (рис. 97).
|
| Рис. 97. Окисление различных неорганических субстратов аэробными хемолитотрофами с участием электронтранспортной цепи и восстановление НАД+ в результате обратного переноса электронов. Обозначения см. на рис. 95 (по Кондратьевой, 1983) |
Все это создает большую нагрузку на конечный этап дыхательной цепи. Действительно, у железобактерий и нитрификаторов конечный участок дыхательной цепи развит очень сильно: эти бактерии характеризуются исключительно высоким содержанием цитохромов с и а, во много раз превышающим их содержание у гетеротрофов. Рассмотрим теперь более подробно отдельные группы хемолитотрофных эубактерий.
Эубактерии, окисляющие соединения серы
Описано много представителей разных групп эубактерий, способных окислять восстановленные соединения серы, например, сероводород, тиосульфат, а также молекулярную серу. Это фототрофы, осуществляющие бескислородный фотосинтез, некоторые типичные гетеротрофные бактерии родов Bacillus, Pseudomonas, Arthrobacter и других и группы бесцветных серобактерий и тионовых бактерий. Окисление серы и ее восстановленных соединений может служить источником клеточной энергии, электронов при фотосинтезе, использоваться для детоксикации образующейся при дыхании перекиси водорода.
Тионовые бактерии. Использование процесса окисления серы и ее неорганических восстановленных соединений для получения клеточной энергии показано для группы тионовых бактерий, представленных родами Thiobacillus, Thiomicrospira, Thiodendron и др. Это одноклеточные организмы разной морфологии и размеров; неподвижные или подвижные (движение осуществляется с помощью полярно расположенных жгутиков); бесспоровые. Размножаются делением или почкованием. Имеют клеточную стенку грамотрицательного типа. Для некоторых представителей рода Thiobacillus характерна развитая система внутрицитоплазматических мембран.
Для тионовых бактерий показана способность окислять с получением энергии помимо молекулярной серы (S0) многие ее минеральные восстановленные соединения: сульфид (S2 – ), тиосульфат (S2O32 – ) сульфит (SO32 – ), тритионат (S3O62 – ), тетратионат (S4O62 – ). Некоторые тионовые бактерии могут получать энергию за счет окисления тиоцианата (CNS – ), диметилсульфида (CH3SCH3), диметилдисульфида (CH3SSCH3), а также сульфидов тяжелых металлов. Там, где в качестве промежуточного продукта окисления образуется молекулярная сера, она откладывается вне клетки. Thiobacillus ferrooxidans получает энергию, окисляя также двухвалентное железо.
Полное ферментативное окисление тионовыми бактериями молекулярной серы и различных ее восстановленных соединений приводит к образованию сульфата. Окисление сероводорода до сульфата сопровождается потерей 8 электронов, поступающих в дыхательную цепь, при этом в качестве промежуточных продуктов образуется молекулярная сера и сульфит:
H2S ® S0 ® SO32– ® SO42–
На этапе окисления сульфита до сульфата, протекающего с образованием аденилированного промежуточного соединения аденозинфосфосульфата (АФС), имеет место субстратное фосфорилирование, позволяющее запасать освобождающуюся при этом энергию в молекулах АТФ:
SO32 – + АМФ ® АФС + 2e–;
АФС + ФН ® SO42 – + АДФ;
Далее с помощью аденилаткиназы из АДФ синтезируется АТФ:
2АДФ ® АМФ + АТФ.
Основное же количество энергии тионовые бактерии получают в результате переноса образующихся при окислении восстановленной серы электронов, поступающих в дыхательную цепь на уровне цитохрома c (рис. 97). Дыхательная цепь тионовых бактерий содержит все типы переносчиков, характерных для аэробных хемогетеротрофов. У тионовых бактерий обнаружены флавопротеины, убихиноны, FeS-белки, цитохромы типа b, c, цитохромоксидазы o, d, a + a3.
В большинстве случаев конечным акцептором электронов служит O2, который не может быть заменен никаким другим акцептором. Рост отдельных штаммов возможен в микроаэробных условиях. Некоторые тионовые бактерии являются факультативными аэробами; они могут использовать в качестве конечного акцептора электронов не только O2, но и нитраты, восстанавливая их до N2 или только до нитрита. В анаэробных условиях использование нитратов в качестве конечного акцептора электронов индуцирует синтез диссимиляционной нитратредуктазы, осуществляющей перенос электронов дыхательной цепи на нитраты.
Некоторые виды относятся к облигатным хемолитоавтотрофам, другие — могут расти как хемолитоавтотрофно, так и хемоорганогетеротрофно, используя в последнем случае в качестве источника углерода и энергии ряд органических соединений (кислоты, сахара, спирты, аминокислоты). Наконец, описаны тионовые бактерии, растущие хемолитогетеротрофно, используя в качестве источника углерода только органические соединения, а энергию получая за счет окисления восстановленных соединений серы. Основным механизмом ассимиляции CO2 служит восстановительный пентозофосфатный цикл, обнаруженный у всех тионовых бактерий. Вспомогательную роль играют реакции карбоксилирования трехуглеродных соединений, в первую очередь фосфоенолпировиноградной кислоты.
Поскольку у тионовых бактерий место включения электронов в дыхательную цепь находится на уровне цитохрома c, у них функционирует система обратного переноса электронов для обеспечения конструктивных процессов молекулами НАДxH2.
У разных представителей этой группы, способных расти, используя органические соединения, обнаружены активности ферментов гликолиза, окислительного пентозофосфатного пути, пути Энтнера — Дудорова. Описано функционирование "замкнутого" и "разорванного" ЦТК, а у некоторых тиобацилл — глиоксилатного шунта.
Тионовые бактерии приспособлены к разным условиям обитания. Thiobacillus thiooxidans и Т. ferrooxidans — ярко выраженные ацидофилы (оптимальный pH 2–4), Т. denitrificans и Т. thioparus, наоборот, развиваются только в нейтральной и щелочной среде (pH 7–10). Большинство тиобацилл относятся к мезофилам с оптимальной температурой роста приблизительно 30°. В последнее время описаны термофильные штаммы, растущие при 60–70°.
Бесцветные серобактерии очень напоминают цианобактерии, являясь как бы их непигментированными аналогами. H2 основании морфологических признаков делятся на две группы: одна представлена одноклеточными формами (роды Achromatium, Macromonas и др.), в составе другой объединены нитчатые организмы (роды Beggiatoa, Thiothrix, Thioploca). Одноклеточные бесцветные серобактерии — подвижные или неподвижные, различающиеся размерами формы. Нитчатые организмы представлены также неподвижными или способными к скользящему движению видами (см. рис. 45, 1).
Единственный общий признак группы — способность откладывать серу в периплазматическом пространстве клеток. Вопрос о значении, которое имеет окисление восстановленных соединений серы для этой группы бактерий, имеет длинную историю. С. Н. Виноградский, наблюдая в 1887–1889 гг. в клетках Beggiatoa при выращивании на среде с H2S отложение гранул серы и их последующее исчезновение после исчерпания сероводорода из среды, пришел к выводу, что энергия, освобождающаяся при окислении H2S до S0 и затем до SO42 – c участием O2, используется этим организмом для ассимиляции CO2. Таким образом, работая с Beggiatoa, С. Н. Виноградский сформулировал положение о принципиально новом способе существования организмов — хемолитоавтотрофии. Однако позднее выяснилось, что культуры, с которыми работал С. Н. Виноградский, были нечистыми. И до сих пор большинство представителей этой группы не выделены в виде чистых культур, что затрудняет изучение их физиологии. Для некоторых бесцветных серобактерий, в том числе и для Beggiatoa, были получены данные в пользу того, что окисление H2S может быть связано с получением клеткой энергии.
В то же время показано, что важная физиологическая особенность бесцветных серобактерий — образование ими значительных количеств перекиси водорода. Более 80 — 90% потребленного клетками в процессе дыхания O2 восстанавливается лишь до H2O2. Накоплению в клетках перекиси водорода способствует низкая каталазная активность, обнаруженная у этих организмов. Была выявлена определенная связь между окислением H2S и кислородным метаболизмом бесцветных серобактерий. Оказалось, что окисление соединений серы используется этими организмами для удаления H2O2. Отложение молекулярной серы является, таким образом, результатом окисления сульфидов среды перекисью водорода, образующейся в клетке. Перекисный механизм окисления восстановленных соединений серы исключает возможность использования организмами энергии этого процесса.
Вопрос о способности бесцветных серобактерий существовать автотрофно также пока не доказан: чистые культуры могут расти только в присутствии органических соединений; не обнаружено типичных для эубактерий механизмов автотрофной ассимиляции CO2. Все это заставляет склоняться в пользу того, что бесцветные серобактерии могут существовать только хемогетеротрофно. В микроаэробных условиях некоторые штаммы Beggiatoa обнаруживают способность к азотфиксации.
Распространение и роль в природе. Окисление неорганических восстановленных соединений серы с помощью фототрофных и хемотрофных эубактерий является одним из звеньев круговорота серы в природе. В первом случае процесс протекает в анаэробных условиях, во втором — в аэробных. Хемотрофы, окисляющие серу, обитают в морских и пресных водах, содержащих O2, в аэробных слоях почв разного типа. Поскольку эта группа объединяет организмы с разными физиологическими свойствами, ее представителей можно обнаружить в кислых горячих серных источниках, кислых шахтных водах, в водоемах со щелочной средой и высокой концентрацией NaCl.
Хемолитоавтотрофные серобактерии обнаружены на глубине 2600–6000 м в местах, где на поверхность дна океана из недр земной коры выходят горячие источники. Вода источников, называемая гидротермальной жидкостью, имеет температуру до 350°, не содержит совсем O2 и NO3 – но обогащена H2S, CO2 и NH4+. H2 дне океана гидротермальная жидкость смешивается с окружающей морской водой, имеющей температуру 2°, которая, наоборот, не содержит H2S и характеризуется достаточно высокими уровнями O2 и NO3 – . Эти области отличаются также высоким давлением н полным отсутствием света.
К удивлению исследователей, вокруг выходов гидротермальной жидкости были обнаружены плотные скопления необычных беспозвоночных животных, среди которых преобладали гигантские живущие в трубках черви Riftia pachyptila длиной до 2,5 м и толщиной до 5 см, крупные белые двустворчатые моллюски Calyptogena magnified и мидии Bathymodiolus thermophilus. Имелись там креветки, крабы и рыбы в немалых количествах. Как объяснить наличие таких "оазисов" жизни в "пустыне", которой до недавнего времени считали дно океана на большой глубине?
Из проб воды, взятых у гидротермальных выходов, выделены бактерии, среди которых некоторые виды были H2S-окисляющими хемолитоавтотрофами, идентифицированными как представители родов Thiomicrospira и Thiobacillus. Такие бактерии могут составить первое звено трофической цепи в экосистеме гидротермальных источников, обеспечивая пищей различные виды животных.
Однако вскоре обнаружилось, что одно из преобладающих животных R. pachyptila не может питаться частичками пищи, поскольку представляет собой просто замкнутый мешок без ротового, анального отверстий и пищеварительной системы. H2 переднем конце тела животного располагаются ярко окрашенные щупальца. В мешке заключены внутренние органы, самый крупный из них, занимающий почти всю полость тела, — трофосома, в которой обнаружено множество бактерий, окисляющих H2S, запасающих энергию в молекулах АТФ и использующих ее затем для фиксации CO2 в восстановительном пентозофосфатном цикле. Бактерии локализованы внутри клеток трофосомы. R. pachyptila получает от бактерий органические соединения, а в обмен поставляет им необходимые для осуществления хемоли-тоавтотрофного метаболизма вещества (CO2, O2, H2S), поглощая их из внешней среды щупальцами (темно-красный цвет щупалец обусловлен присутствием большого количества крови, богатой гемоглобином), откуда они по кровеносной системе переносятся в трофосому к бактериям. Таким образом, отношения между R. pachyptila и серобактериями — типичный пример внутриклеточного симбиоза мутуалистической природы.
Исследования других животных, обитающих у гидротермальных источников, показали, что R. pachyptila — не единственный вид, симбиотически связанный с хемолитоавтотрофными бактериями. Моллюски C. magnifica и В. thermophilus также содержат хемосинтетических эндосимбионтов, но бактерии у них обитают в жабрах, где могут легко получать O2 и CO2 из проходящего сквозь жабры потока воды, a H2S моллюск поглощает своей вытянутой в длину ногой, которая погружена в источник, где концентрация сульфида наиболее высокая. Из ноги H2S переносится с кровью в жабры к бактериям.
Симбиозы, подобные описанному выше, обнаружены в других местах, богатых H2S, в том числе в мангровых и травяных соленых болотах, у мест просачивания нефти, в районах сброса сточных вод. Число видов беспозвоночных, в которых найдены такие эндосимбионты, достаточно велико, и список этот постоянно растет.
Важное следствие открытия симбиозов, компонентом которых являются хемолитоавтотрофные бактерии, — существование экосистем, в которых первичными продуцентами служат не фотоавтотрофные, а хемолитоавтотрофные организмы.
Окисление восстановленных соединений серы до сульфатов, осуществляемое этими бактериями, приводит к подкислению окружающей среды, что может иметь положительные и отрицательные последствия. Подкисление почвы приводит к переводу некоторых соединений, например фосфатов, в растворимую форму, что делает их доступными для растений. Окисление нерастворимых сульфидных минералов, сопровождающееся переводом металлов в растворимую форму, облегчает их добычу. Однако накопление серной кислоты в результате деятельности этих бактерий может приводить к порче и разрушению различных сооружений.
Железобактерии
Способность осаждать окислы железа и марганца на поверхности клеток присуща многим эубактериям, различающимся морфологическими и физиологическими признаками и принадлежащим к разным таксономическим группам. В вопросе о том, какие организмы следует относить к железобактериям, нет единого мнения. С. Н. Виноградский впервые термин "железобактерии" применил для обозначения организмов, использующих энергию окисления Fe2+ до Fe3+ для ассимиляции CO2, т. е. способных существовать хемолитоавтотрофно. X. Молиш к железобактериям относил все организмы, откладывающие вокруг клеток окислы железа или марганца независимо от того, связан ли этот процесс с получением клеткой энергии.
Накопление окислов железа и марганца на поверхности бактериальных клеток — результат двух взаимосвязанных процессов: аккумуляции (поглощения) клетками этих металлов из раствора и окисления, сопровождающегося обильным отложением нерастворимых окислов на поверхности бактерий. Процесс аккумуляции тяжелых металлов из растворов в основе имеет физико-химическую природу и в значительной мере обусловлен химическим составом и свойствами поверхностных структур клетки. Он включает связывание металлов внеклеточными структурами (капсулы, чехлы, слизистые выделения), клеточной стенкой и ЦПМ. Сорбционные свойства поверхностных клеточных структур определяются в большой степени суммарным отрицательным зарядом молекул, входящих в их состав. Поглощение металлов приводит к значительному концентрированию их вокруг клеток по отношению к среде. Коэффициент накопления для железа и марганца может достигать величины 105–106.
Как известно, Fe2+ подвергается быстрому химическому окислению молекулярным кислородом при pH>5,5, что приводит к образованию нерастворимого Fe(OH)3. Последний вместе с Fe2+ неспецифически связывается клеточными кислыми экзополимерами. Подобный тип накопления железа не зависит от метаболической активности клеток.
Mn2+ более устойчив к окислению O2, чем Fe2+. Его химическое окисление (Mn2+ ® Mn4+) молекулярным кислородом с заметной скоростью происходит только при pH>8,5. Поэтому в нейтральной среде окисление марганца имеет только ферментативную природу. Окисление Fe2+ и Mn2+ с последующим отложением нерастворимых окислов вокруг бактериальных клеток может быть результатом взаимодействия ионов металлов с продуктами бактериального метаболизма, в частности с H2O2, образующейся в процессе окисления органических веществ при переносе электронов по дыхательной цепи. Перекись водорода, возникающая в качестве промежуточного или конечного продукта окисления, выделяется из клеток и накапливается в окружающих их структурах. В нейтральной или слабокислой среде окисление Fe2+ до Fe3+ происходит в результате непосредственного взаимодействия с H2O2:
2Fe2+ + H2O2 + 2Н+ ® 2Fe3+ + 2H2O.
Окисление марганца при взаимодействии с H2O2 осуществляется при участии каталазы, выполняющей пероксидазную функцию. Mn2+ в этом случае служит донором электронов:
Mn2+ + 2H2O2 ® MnO2 + 2H2O.
Описанные выше процессы протекают в капсулах, чехлах, слизистых выделениях, на поверхности клеточной стенки, в которых концентрируются все компоненты реакции: восстановленные формы железа и марганца, перекись водорода, каталаза. Физиологический смысл процессов окисления Fe2+ и Mn2+ с участием H2O2 — детоксикация вредного продукта метаболизма. Ни в одном случае окисление железа и марганца не приводит к получению бактериями энергии.
Наконец, среди железобактерий есть организмы, у которых окисление Fe2+ связано с получением энергии. В этом случае отложение окислов железа служит показателем активности энергетических процессов. Возможность получения энергии бактериями при окислении Mn2+ экспериментально не доказана.
В изучении железобактерий в последнее время достигнуты большие успехи, связанные с получением чистых культур ряда этих организмов. Стало понятным, что это разнообразная группа бактерий, способных окислять и откладывать окислы железа и/или марганца вне или иногда внутри клетки66. H2 основании морфологических характеристик все железобактерии могут быть разделены на две группы: нитчатые и одноклеточные.
66 К железобактериям, откладывающим железо внутри клетки, относятся магнитотактические бактерии.
К первой группе относятся грамотрицательные нитчатые бактерии, окруженные чехлом. Наиболее широко распространены представители родов Leptothrix и Sphaerotilus (см. рис. 44, 1, 2). Нити неподвижные или передвигающиеся скольжением. В чехлах, окружающих нити, накапливаются окислы железа и марганца (Leptothrix) или только железа (Sphaerotilus и др.).
Железобактерии этой группы — облигатные аэробы, но могут удовлетворительно расти при низком содержании O2 в среде. Оптимальный pH для роста — 6–8. Единственно возможный способ существования — хемоорганогетеротрофия, при этом представители рода Sphaerotilus предпочитают условия с относительно высоким содержанием органических веществ, а многие штаммы Leptothrix — среды с низким уровнем органики.
Окисление железа и марганца и отложение их окислов в чехлах этих бактерий не связано с получением ими энергии. К окислению Fe2+ при pH 6–8 могут приводить процессы как химической, так и биологической природы. Окисление марганца в этих условиях имеет биологическую природу. В обоих случаях окисление связано с действием перекиси водорода, количество которой в среде в определенных условиях может достигать 10–20 мг/л. Процесс локализован в чехлах, где концентрируются продукты метаболизма и внеклеточные ферменты. У мутантов, лишенных чехлов, накопления окислов железа и марганца не происходило. Таким образом, с помощью восстановленных форм железа и марганца обеспечивается удаление H2O2 — токсического продукта клеточного метаболизма.
Помимо бесцветных к нитчатым железобактериям относятся и некоторые фотосинтезирующие эубактерии из группы цианобактерий и скользящих зеленых бактерий.
Вторая группа железобактерий включает одноклеточные организмы из разных таксонов. Она представлена эубактериями с грамположительным и грамотрицательным строением клеточной стенки или без нее, размножающимися поперечным делением или почкованием. Клетки разной формы и размеров (форма может меняться в зависимости от стадии и условий роста), одиночные или формирующие скопления, окруженные капсулами, в которых откладываются окислы железа и марганца. Принадлежащие к этой группе железобактерии распадаются на две подгруппы, различающиеся типом метаболизма и отношением к кислотности среды.
Первая подгруппа объединяет железобактерии, растущие в. нейтральной или слабощелочной среде и характеризующиеся хемоорганогетеротрофным типом метаболизма. Представители подгруппы — свободноживущие микоплазмы, объединенные в роды Metallogenium, Gallionella, Siderococcus. Им свойствен типичный для микоплазм полиморфизм: кокковидные клетки, от которых могут отходить тонкие нити, пучки переплетенных тонких нитей и т. д. H2 поверхности нитей откладываются окислы железа (Gallionella, Siderococcus) или железа и марганца (Metallogenium). Растут в нейтральной или кислой среде. Некоторые из них олиготрофы. Все — аэробы или микроаэрофилы. Отложение окислов железа и марганца — результат химических реакций или функционирования перекисного пути и не имеет отношения к получению клетками энергии.
Вторую подгруппу составляют в большинстве аэробные ацидофильные формы. Оптимальный pH их роста лежит ниже 4,5 (2–3). В этих условиях Fe2+ в присутствии O2 устойчиво к химическому окислению. Для ацидофильных железобактерий установлена способность получать энергию в результате окисления двухвалентного железа.
Основным представителем железобактерий с энергетическим метаболизмом хемолитотрофного типа является Thiobacillus ferrooxidans, относящийся к группе тионовых бактерий и обладающий способностью получать энергию также в результате окисления различных восстановленных соединений серы. Окислять закисное железо с получением клеткой энергии способна и выделенная недавно облигатно ацидофильная бактерия Leptospirillum ferrooxidans, близкая по ряду свойств к Т. ferrooxidans, но в отличие от последнего не окисляющая соединения серы.
Leptospirillum ferrooxidans и большинство изученных штаммов Т. ferrooxidans принадлежат к облигатным хемолитоавтотрофам, использующим энергию окисления железа для ассимиляции CO2, служащей основным или единственным источником углерода. Некоторые штаммы Т. ferrooxidans оказались способными расти на средах с органическими соединениями, являясь, таким образом, факультативными хемолитоавтотрофами. Наконец, описаны термофильные бактерии, получающие энергию в результате окисления Fe2+ и нуждающиеся для роста в органических соединениях, т. е. осуществляющие метаболизм хемолитогетеротрофного типа.
Окисление железа, приводящее к получению энергии, происходит в соответствии с уравнением
2Fe2+ + 1/2O2 + 2Н+ ® 2Fe3+ + H2O,
что сопровождается незначительным изменением уровня свободной энергии (DG0' при pH 2 равно — 33 кДж/моль). Поэтому для обеспечения энергией клетке необходимо "переработать" большие количества железа.
Механизм окисления Fe2+ в дыхательной цепи изучен у Т. ferrooxidans. Дыхательная цепь этой бактерии содержит все типы переносчиков, характерные для дыхательной системы аэробных хемоорганотрофных эубактерий, но участок цепи, связанный с получением энергии, очень короток (рис. 98, А).

|
| Рис. 98. Схема энергетических процессов у представителей разных групп хемолитотрофных эубактерий: А — Thiobacillus ferrooxidans; Б — Nitrobacter; В — Paracoccus denitrificans: РЦ — рустицианин; ФП — флавопротеин; УХ — убихинон; b, c, o, a1, aa3 — цитохромы (по Haddock, Jones, 1977; Jones, 1980) |
Окисление Fe2+ происходит на внешней стороне ЦПМ; в цитозоль через мембрану железо не проникает. Электроны с Fe2+ акцептируются особым медьсодержащим белком — рустицианином, находящимся в периплазматическом пространстве.
Затем с рустицианина они передаются на цитохром c, локализованный на внешней стороне ЦПМ, а с него на цитохром a1, расположенный на внутренней стороне мембраны. Перенос электронов с цитохрома a1 на 1/2O2, сопровождающийся поглощением из цитоплазмы 2H+, приводит к восстановлению молекулярного кислорода до H2O. Особенность дыхательной цепи Т. ferrooxidans — отсутствие переноса через мембрану протонов, а перенос только электронов. Градиент H+ по обе стороны ЦПМ поддерживается как за счет поглощения протонов из цитоплазмы, так и в результате низкого pH внешней среды, в которой обитают эти бактерии. Синтез АТФ происходит за счет движения H+ из внешней среды в цитоплазму через АТФ-синтазный комплекс. Движущей силой служит в основном DpH. Для синтеза 1 молекулы АТФ необходимо окислить как минимум 2 молекулы Fe2+.
Образование восстановителя происходит в результате энергозависимого обратного переноса электронов. Активность участка дыхательной цепи, обеспечивающей обратный электронный транспорт, на порядок ниже активности короткого участка, функционирование которого приводит к получению энергии. В целом для фиксации 1 молекулы CO2 в восстановительном пентозофосфатном цикле необходимо окислить больше 22 молекул Fe2+. Таким образом, из всех представителей эубактерий, у которых обнаружена способность к окислению железа и/или марганца, только облигатно ацидофильные формы могут использовать энергию окисления Fe2+ для ассимиляции CO2, т. е. существовать хемолитоавтотрофно. Именно они являются истинными железобактериями, соответствуя тому названию, которое было введено С. Н. Виноградским.
Для остальных организмов образование окислов железа и марганца не связано с получением энергии и происходит в результате неспецифических реакций ионов металлов с продуктами метаболизма, прежде всего продуктами неполного восстановления O2. Неспецифичность функции перекисного окисления железа и марганца, проявляющейся у широкого круга эубактерий, ставит вопрос о правомерности использования термина "железобактерии" в значении, предложенном X. Молишем. Некоторые авторы в связи с этим считают целесообразным для обозначения остальных организмов использовать названия "железоокисляющие" и "марганецокисляющие" бактерии.
Эубактерии, описанные в этом разделе, широко распространены в природе и могут существовать в большом диапазоне условий. Облигатные ацидофилы обнаружены в подземных водах сульфидных месторождений, кислых водах железистых источников и кислых озерах с высоким содержанием закисного железа. Нитчатые формы также занимают вполне определенные экологические ниши. Представители рода Leptothrix — обитатели олиготрофных железистых поверхностных вод, Sphaerotilus предпочитают среды с высоким содержанием органических веществ.
Нитрифицирующие бактерии
Получают энергию в результате окисления восстановленных соединений азота (аммиака; азотистой кислоты). Впервые чистые культуры этих бактерий получил С. Н. Виноградский в 1892 г., установивший их хемолитоавтотрофную природу. В IX издании Определителя бактерий Берги все нитрифицирующие бактерии выделены в семейство Nitrobacteraceae и разделены на две группы в зависимости от того, какую фазу процесса они осуществляют. Первую фазу — окисление солей аммония до солей азотистой кислоты (нитритов) — осуществляют аммонийокисляющие бактерии (роды Nitrosomonas, Nitrosococcus, Nitrosolobus и др.):
NH4+ + 1,5O2 ® NO2 – + H2O + 2H+.
Вторую фазу — окисление нитритов до нитратов — осуществляют нитритокисляющие бактерии, относящиеся к родам Nitrobacter, Nitrococcus и др.:
NO2 – + 1/2O2 ® NO3 – .
Группа нитрифицирующих бактерий представлена грамотрицательными организмами, различающимися формой и размером клеток, способами размножения, типом жгутикования подвижных форм, особенностями клеточной структуры, молярным содержанием ГЦ-оснований ДНК, способами существования.
Все нитрифицирующие бактерии — облигатные аэробы; некоторые виды — микроаэрофилы. Большинство — облигатные автотрофы, рост которых ингибируется органическими соединениями в концентрациях, обычных для гетеротрофов. С использованием 14C-соединений показано, что облигатные хемолитоавтотрофы могут включать в состав клеток некоторые органические вещества, но в весьма ограниченной степени. Основным источником углерода остается CO2, ассимиляция которой осуществляется в восстановительном пентозофосфатном цикле. Только для некоторых штаммов Nitrobacter показана способность к медленному росту в среде с органическими соединениями в качестве источника углерода и энергии.
Процесс нитрификации локализован на цитоплазматической и внутрицитоплазматических мембранах. Ему предшествует поглощение NH4+ и перенос его через ЦПМ с помощью медьсодержащей транслоказы. При окислении аммиака до нитрита атом азота теряет 6 электронов. Предполагается, что на первом этапе аммиак окисляется до гидроксиламина с помощью моно-оксигеназы, катализирующей присоединение к молекуле аммиака 1 атома O2; второй взаимодействует, вероятно, с НАД-H2, что приводит к образованию H2O:
NH3 + O2 + НАД-H2 ® NH2OH + H2O + НАД+.
Гидроксиламин далее ферментативно окисляется до нитрита:
NH2OH + O2 ® NO2 – + H2O + H+.
Электроны от NH2OH поступают в дыхательную цепь на уровне цитохрома c и далее на терминальную оксидазу. Их транспорт сопровождается переносом 2 протонов через мембрану, приводящим к созданию протонного градиента и синтезу АТФ. Гидроксиламин в этой реакции, вероятно, остается связанным с ферментом.
Вторая фаза нитрификации сопровождается потерей 2 электронов. Окисление нитрита до нитрата, катализируемое молибденсодержащим ферментом нитритоксидазой, локализовано на внутренней стороне ЦПМ и происходит следующим образом:
NO2 – + H2O ® NO3 – + 2H+ + 2е–.
Электроны поступают на цитохром a1 и через цитохром c на терминальную оксидазу aa3 где акцептируются молекулярным кислородом (рис. 98, Б). При этом происходит перенос через мембрану 2H+. Поток электронов от NO2– на O2 происходит с участием очень короткого отрезка дыхательной цепи. Так как E0 пары NO2–/NO3– равен +420 мВ, восстановитель образуется в процессе энергозависимого обратного переноса электронов. Большая нагрузка на конечный участок дыхательной цепи объясняет высокое содержание цитохромов c и a у нитрифицирующих бактерий.
Многие хемоорганогетеротрофные бактерии, принадлежащие к родам Arthrobacter, Flavobacterium, Xanthomonas, Pseudomonas и др., способны окислять аммиак, гидроксиламин и другие восстановленные соединения азота до нитритов или нитратов. Процесс нитрификации этих организмов, однако, не приводит к получению ими энергии. Изучение природы этого процесса, получившего название гетеротрофной нитрификации, показало, что, возможно, он связан с разрушением образуемой бактериальными культурами перекиси водорода с помощью пероксидазы. Образующийся при этом активный кислород окисляет NH3 до NO2–.
Нитрифицирующие бактерии обнаружены в водоемах разного типа и в почвах, где они, как правило, развиваются совместно с бактериями, жизнедеятельность которых приводит к образованию исходного субстрата нитрификации — аммиака.
Процесс нитрификации, являясь важным звеном в круговороте азота в природе, имеет как положительные, так и отрицательные стороны. Переведение азота из аммонийной формы в нитратную способствует обеднению почвы азотом, поскольку нитраты легко вымываются из почвы. В то же время нитраты — хорошо используемый растениями источник азота. Связанное с нитрификацией подкисление почвы улучшает растворимость и, следовательно, доступность некоторых жизненно необходимых элементов, в первую очередь фосфора и железа.
Водородные бактерии
К водородным бактериям относят эубактерии, способные получать энергию путем окисления молекулярного водорода с участием O2, а все вещества клетки строить из углерода CO2. Таким образом, водородные бактерии — это хемолитоавтотрофы, растущие при окислении H2 в аэробных условиях:
H2 + 1/2O2 ® H2O.
Помимо окисления для получения энергии молекулярный водород используется в конструктивном метаболизме. H2 5 молекул H2, окисленного в процессе дыхания, приходится 1 молекула H2, затрачиваемого на образование биомассы:
6H2 + 2O2 + CO2 ® CH2O + 5H2O.
Молекулярный водород — наиболее распространенный неорганический субстрат, используемый эубактериями для получения энергии в процессе окисления. Число бактерий, растущих хемолитотрофно на основе использования H2 в качестве источника энергии, намного больше организмов, использующих для этой цели другие неорганические субстраты (восстановленные соединения серы, азота, железа).
Способность к энергетическому использованию H2 может сочетаться с конструктивным метаболизмом облигатно гетеротрофного типа (например, у представителей родов Azotobacter или Acetobacter) или происходить в строго анаэробных условиях (сульфатвосстанавливающие бактерии), что не позволяет относить обладающие этими особенностями организмы к водородным бактериям. Таким образом, водородные бактерии представляют только часть эубактерии, способных использовать H2 для получения энергии. Пути использования молекулярного водорода эубактериями суммированы в табл. 31. Водородные бактерии характеризуются способностью сочетать конструктивный метаболизм автотрофного типа (вариант 1) с получением энергии за счет окисления H2 с участием молекулярного кислорода (вариант 3).
Таблица 31. Пути использования молекулярного водорода эубактериями
| Процесс | Конечный акцептор водорода | Конечный продукт |
| Восстановительное ассимилирование углерода | CO2 | вещества клетки |
| Восстановительное ассимилирование углерода | органические соединения | вещества клетки |
| Дыхание | O2 | H2O |
| Нитратное дыхание, денитрификация | NO3–, NO2–, NO, N2O | N2, NO2– |
| Сульфатное дыхание | SO42–, SO32–, S2O32– | H2S |
| Фумаратное дыхание | фумарат | сукцинат |
| Образование ацетата | CO2 | CH3COOH |
Впервые водородные бактерии были описаны А. Ф. Лебедевым и Г. Казерером (Н. Kaserer) в 1906 г., а в 1909 г. С. Орла-Йенсен выделил их в самостоятельный род Hydrogenomonas.
Последующее изучение обнаружило сходство водородных бактерий с представителями разных родов гетеротрофных бактерий: Pseudomonas, Alcaligenes, Nocardia и др. Стало ясно, что водородные бактерии — не таксономическая группа, а организмы, объединяемые на основании нескольких физиологических признаков. Род Hydrogenomonas был ликвидирован, и виды, входившие в его состав, распределены по другим таксономическим группам.
К водородным бактериям относятся представители 20 родов, объединяющих грамположительные и грамотрицательные формы разной морфологии, подвижные и неподвижные, образующие споры и бесспоровые, размножающиеся делением и почкованием. Молярное содержание ГЦ-оснований ДНК водородных бактерий находится в диапазоне от 48 до 72%.
За исключением недавно описанных термофильных бактерий, выделенных в род Hydrogenobacter и характеризующихся облигатной хемолитоавтотрофией, все остальные водородные бактерии — факультативные формы, использующие в качестве источника углерода и энергии также разнообразные органические соединения, некоторые из них — и одноуглеродные соединения, более восстановленные, чем CO2 (окись углерода, метанол, формиат и др.). Ассимиляция CO2 происходит в восстановительном пентозофосфатном цикле. Водородные бактерии, растущие на органических соединениях, имеют тот же метаболический аппарат, что и хемоорганогетеротрофные эубактерии. Метаболизирование органических соединений у разных представителей этой группы осуществляется с помощью гликолитического, окислительного пентозофосфатного и Энтнера — Дудорова путей, а также ЦТК. и глиоксилатного шунта.
Электронтранспортная цепь водородных бактерий по составу аналогична митохондриальной (см. рис. 94). Большинство из них относится к облигатным аэробам. Однако среди облигатных аэробов преобладают виды, тяготеющие к низким концентрациям O2 в среде. Особенно чувствительны к O2 водородные бактерии, растущие хемолитоавтотрофно, а также в условиях фиксации молекулярного азота. Последнее объясняется инактивирующим действием молекулярного кислорода на гидрогеназу и нитрогеназу — ключевые ферменты метаболизма H2 и фиксации N2. Для некоторых водородных бактерий показана способность расти и в анаэробных условиях, используя в качестве конечного акцептора электронов вместо O2 нитраты, нитриты или окислы железа. Примером факультативно аэробных водородных бактерий может служить Paracoccus denitrificans, у которого в аэробных условиях работает электронтранспортная цепь, аналогичная митохондриальной, а в отсутствие O2 электроны с помощью соответствующих редуктаз переносятся на NO3 – и NO2 – , восстанавливая их до N2 (рис. 98, В). Однако большая часть факультативно аэробных водородных бактерий способна к восстановлению нитратов только до нитритов.
Как известно, способность к окислению H2 связана с наличием гидрогеназ, катализирующих реакцию: H2 ® 2H+ + 2e–. Гидрогеназы обнаружены у многих представителей прокариотного мира. В клетке гидрогеназы могут находиться в растворимом или связанном с мембранами состоянии. По этому признаку все изученные водородные бактерии могут быть разделены на 3 группы. Большинство содержит только одну форму фермента — связанную с мембранами. Есть виды, содержащие обе формы или только растворимую (цитоплазматическую) гидрогеназу.
Гидрогеназы, имеющие различную локализацию, вероятно, выполняют в клетке разные функции. Связанный с мембранами фермент не способен восстанавливать НАД+, передает электроны непосредственно в дыхательную цепь на уровне флаво-протеинов, хинонов или цитохрома b и, таким образом, имеет отношение только к энергетическим процессам. Растворимая гидрогеназа переносит электроны на молекулы НАД+, которые участвуют далее в различных биосинтетических реакциях.
Если водородные бактерии содержат обе формы гидрогеназы, функции между ними четко разделены. В случае отсутствия у водородных бактерий цитоплазматической гидрогеназы возникает проблема получения восстановителя при хемолитоавтотрофном способе их существования. Она решается с помощью механизма обратного переноса электронов на НАД+. При функционировании только цитоплазматической гидрогеназы она выполняет обе функции: часть восстановительных эквивалентов с НАД-H2 поступает в дыхательную цепь, другая расходуется по каналам конструктивного метаболизма. Таким образом, из всех хемолитоавтотрофных эубактерий только водородные бактерии с помощью определенной формы гидрогеназы могут осуществлять непосредственное восстановление НАД+ окислением неорганического субстрата. В электронтранспортную цепь электроны, следовательно, могут поступать с НАД-H2 или включаться на уровне переносчиков с более положительным окислительно-восстановительным потенциалом. С этим связан энергетический выход процесса: функционирование в дыхательной цепи 3 или 2 генераторов DmH+.
К образованию молекулярного водорода приводят разные процессы, в том числе и биологические. Активными продуцентами H2 являются эубактерий. Также активно осуществляется и потребление H2, важная роль в этом принадлежит водородным бактериям. Нахождение в природе и возможность размножения этих бактерий определяются рядом факторов; основные из них — наличие H2 и аэробные условия.
В последнее время водородные бактерии привлекают к себе внимание возможностью практического использования: для получения кормового белка, а также ряда органических соединений (кислоты, аминокислоты, витамины, ферменты и др.).
Карбоксидобактерии
Карбоксидобактерии — аэробные эубактерий, способные расти, используя окись углерода (CO) в качестве единственного источника углерода и энергии. Таким свойством обладают некоторые представители родов Pseudomonas, Achromobacter, Comamonas67.
67 Способность окислять CO обнаружена у представителей прокариот, принадлежащих к эубактериям (пурпурные несерные бактерии, цианобактерии, клостридии) и архебактериям (метанобразующие бактерии). Однако в большинстве случаев этот процесс не поддерживает рост культур и механизм его неясен.
Карбоксидобактерии могут расти автотрофно, ассимилируя CO2 в восстановительном пентозофосфатном цикле, а также использовать в качестве единственного источника углерода и энергии различные органические соединения. При выращивании на среде с CO2 в качестве единственного источника углерода большинство Карбоксидобактерии энергию могут получать за счет окисления молекулярного водорода, при этом рост на среде с CO2 + H2 происходит активнее, чем на среде с CO. Это дало основание некоторым исследователям рассматривать Карбоксидобактерии как особую физиологическую подгруппу водородных бактерий. В то же время способность использовать в качестве субстрата дыхательный яд указывает на осуществление карбоксидобактериями нового типа хемолитотрофного метаболизма. Кроме того, обнаружение у них ферментов и факторов, отсутствующих у водородных бактерий, неспособность некоторых карбоксидобактерий окислять H2 и ряд других признаков позволяют сделать вывод об определенной обособленности этой группы эубактерий.
Использование CO карбоксидобактериями происходит путем его окисления в соответствии с уравнением:
CO + H2O ® CO2 + 2e – + 2H+.
Продукт реакции используется далее по каналам автотрофного метаболизма. (Таким образом, при выращивании карбоксидобактерий на среде с CO в качестве единственного источника углерода и энергии источником углерода служит не CO, а CO2). Теоретически суммарное уравнение окисления CO и синтеза клеточной биомассы карбоксидобактерий может быть представлено в следующем виде:
7СО + 2,5O2 + H2O ® 6CO2 + (CH2O),
где (CH2O) — символ биомассы. Из уравнения видно, что окисление CO — неэффективный способ получения энергии. Карбоксидобактерий для синтеза клеточного вещества вынуждены окислять большое количество CO: на биосинтетические процессы в разных условиях роста идет от 2 до 16% углерода CO.
Окисление CO карбоксидобактериями осуществляется с участием по крайней мере одного специфического фермента — CO-оксидазы. Это флавопротеин, в молекуле которого содержится молибден и FeS-центры. Фермент в клетке находится в растворимой и связанной с мембраной форме. Растворимая CO-оксидаза локализована с внутренней стороны ЦПМ. При росте карбоксидобактерий на CO в качестве единственного источника углерода и энергии CO-оксидаза выполняет следующие функции: окисляет CO до CO2, передает электроны в дыхательную цепь и участвует в синтезе НАД-H2 путем обратного переноса электронов.
Состав дыхательных цепей карбоксидобактерий аналогичен таковому водородных бактерий. Для карбоксидобактерий Pseudomonas carboxydovorans показано, что дыхательная цепь разветвлена на уровне убихинона или цитохрома b. Одна ветвь (органотрофная) содержит цитохромы b558, c и a1, вторая (литотрофная) — цитохромы b561 и o. При окислении органического субстрата электроны поступают преимущественно в органотрофную ветвь цепи, при окислении H2 и CO — в обе. Низкая энергетическая эффективность использования CO карбоксидобактериями указывает на то, что перенос электронов по цепи в этом случае приводит к функционированию, вероятно, 1 генератора DmH+.
Одним из интересных свойств карбоксидобактерий является сам факт использования ими окиси углерода, служащей специфическим ингибитором терминальных оксидаз, таких как цитохромы типа a (см. рис. 94). Для некоторых карбоксидобактерий показана устойчивость к содержанию в атмосфере до 90% CO. В то же время в электронтранспортных цепях этих организмов не обнаружено необычных цитохромов. В качестве механизмов, приводящих к CO-устойчивости этих бактерий, обсуждаются: быстрая детоксикация CO с помощью окисляющего фермента; индукция ответвляющихся от основного пути CO-нечувствительных терминальных оксидаз, через которые и осуществляется перенос электронов на O2; повышенный синтез компонентов электронтранспортной цепи; пространственное разобщение процесса окисления CO и цитохромоксидаз, чувствительных к ней.
Основными источниками окиси углерода в природных условиях являются промышленное производство, транспорт, вулканическая деятельность и биологические процессы. Известно, что CO образуется в результате жизнедеятельности разных организмов (бактерии, грибы, водоросли, животные, растения). Одним из путей удаления этого токсического соединения служит использование его бактериями, и в первую очередь в наибольшей степени приспособленными для этого.
Эубактерий, восстанавливающие сульфаты
Все разобранные выше группы эубактерий, способных расти хемолитоавтотрофно, относятся к облигатным или факультативным аэробам. В отсутствие O2 факультативные аэробы получают энергию в процессе анаэробного дыхания, используя в качестве конечных акцепторов электронов некоторые окисленные соединения, например, нитраты, фумарат и др. Группа сульфатвосстанавливающих эубактерий, насчитывающая более 40 видов, приспособилась получать энергию окислением в анаэробных условиях H2, используя в качестве конечного акцептора электронов сульфат.
К сульфатвосстанавливающим эубактериям относятся организмы с различными морфологическими, физиологическими, биохимическими признаками. Среди них есть одноклеточные и нитчатые формы, неподвижные или передвигающиеся с помощью жгутиков, а трихомные — скольжением. Большинство имеют клеточную стенку грамотрицательного типа. Представители рода Desulfotomaculum характеризуются способностью образовывать эндоспоры. H2 гетерогенность группы указывает большой диапазон молярных значений ГЦ-оснований ДНК (37–67%).
Все сульфатвосстанавливающие бактерии — облигатные анаэробы. Многие из них относятся к категории строгих анаэробов, для роста которых требуется не только отсутствие O2, но и низкий окислительно-восстановительный потенциал среды. В то же время некоторые штаммы проявляют устойчивость к O2 и выживают при разной длительности аэрирования среды.
Число органических субстратов, используемых в качестве источника углерода и энергии в процессе восстановления сульфата, достаточно велико: сахара, спирты, органические кислоты (в том числе жирные кислоты, содержащие до 18 углеродных атомов), аминокислоты, некоторые ароматические соединения. Основным неорганическим источником энергии служит H2. Некоторые виды могут окислять CO в процессе сульфатредукции, осуществляя следующие реакции:
4CO + 4H2O ® 4CO2 + 4H2, DG0' = — 80 кДж/моль CO;
4H2 + SO42– + 2H+ ® H2S + 4H2O, DG0' = — 152 кДж/моль SO42–.
Для биосинтетических процессов при этом используются ацетат и CO2.
Предпринимаемые в течение длительного времени попытки показать способность сульфатвосстанавливающих эубактерий расти автотрофно в условиях окисления H2, сопряженного с восстановлением SO42 – , дали положительные результаты. Хемолитоавтотрофный рост обнаружен у представителей родов Desulfotomaculum, Desulfobacterium, Desulfobacter, Desulfosarcina, Desulfonema. У многих представителей группы выявлена способность в фиксации N2.
Ассимиляция CO2 у разных видов осуществляется по ацетил-КоА-пути (см. рис. 62) или восстановительному ЦТК (см. рис. 76).
В отношении метаболизирования органических соединений сульфатвосстанавливающие эубактерий делят на 2 группы. К .первой относят виды, окисляющие субстраты до ацетата и CO2. Вторую группу составляют организмы, полностью окисляющие органические вещества до CO2. В первом случае окисление субстратов завершается образованием ацетил-КоА, который дальше организмами не может окисляться и преобразуется в ацетилфосфат при участии фосфотрансферазы. Из ацетилфосфата в реакции, катализируемой ацетаткиназой, возникает ацетат. Превращение ацетилфосфата в ацетат сопровождается субстратным фосфорилированием.
При полном окислении органических соединений "судьба" ацетил-КоА разная: он может окисляться через "замкнутый" ЦТК или же по принципиально новому механизму. В этом случае происходит расщепление С-С-связи ацетил-КоА, приводящее в конечном итоге к образованию двух молекул CO2. В качестве промежуточных метаболитов идентифицированы связанные CO, метанол, формиат. Обнаружена высокая активность CO-дегидрогеназы. Все это напоминает ацетил-КоА-путь ассимиляции CO2, описанный у ацетогенных и ряда сульфатвосстанавливающих эубактерий, но функционирующий в обратном направлении (см. рис. 62).
Сульфатвосстанавливающие эубактерий могут получать энергию для роста разными способами. Некоторые виды растут на средах с органическими субстратами без сульфатов. В этом случае единственным источником энергии служит процесс брожения. Состав продуктов брожения довольно разнообразен. Так, пируват сбраживается с образованием ацетата, малат — сукцината, пропионата, ацетата. Сахаролитические сульфатвосстанавливающие эубактерий сбраживают сахара до ацетата, этанола, лактата. Во всех случаях образуются также CO2 и H2.
Специфическим способом получения энергии, послужившим основанием для выделения ряда эубактерий в отдельную физиологическую группу, является сульфатное дыхание. Помимо SO42– конечными акцепторами электронов могут служить и другие соединения серы (тиосульфат, сульфит, молекулярная сера). В последние годы обнаружена способность ряда сульфатвосстанавливающих эубактерий к восстановлению в энергетическом процессе нитратов и нитритов до аммония, селената до селенита (SeO42 – ® SeO32 – ), фумарата до сукцината, а также CO2. В последнем случае это приводит к синтезу ацетата.
Таким образом, основные способы существования сульфатредуцирующих эубактерий включают хемоорганотрофию (источники энергии — брожение или окисление органических субстратов в процессе сульфатного дыхания) или хемолитотрофию (источник энергии — анаэробное окисление H2 с акцептированием электронов на SO42 – ) в сочетании с конструктивным метаболизмом гетеротрофного или автотрофного типа.
Процесс получения энергии в результате сульфатного дыхания состоит из трех этапов: отрыв электронов от энергетического субстрата; перенос их по дыхательной цепи; присоединение к веществам, функционирующим в качестве конечных акцепторов электронов.
У сульфатвосстанавливающих эубактерий этап отрыва электронов от энергетических субстратов катализируют различные субстратные дегидрогеназы (лактат-, пируват-, этанолдегидрогеназы) и гидрогеназы. Активные гидрогеназы, локализованные в цитоплазме и/или связанные с мембранами, обнаружены у многих представителей этой группы.
С помощью этих ферментов электроны передаются в дыхательную цепь. В качестве компонентов электронтранспортной цепи идентифицированы FeS-белки (ферредоксины, рубредоксин), флаводоксин, менахинон, цитохромы типа b, c. Особенностью дыхательной цепи многих сульфатвосстанавливающих эубактерий является высокое содержание низкопотенциального цитохрома c3 (E0' –300 мВ), которому приписывают участие в акцептировании электронов с гидрогеназы. Все перечисленные выше соединения, вероятно, принимают участие в переносе электронов на SO42–, но точная их последовательность и локализация на мембране не установлены. Получены данные, указывающие на то, что окисление H2 происходит на наружной стороне мембраны, а реакция восстановления SO42– — на внутренней. Из этого следует, что окисление H2, сопряженное с восстановлением SO42–, связано с трансмембранным окислительно-восстановительным процессом. Перенос электронов по дыхательной цепи сопровождается генерированием DmH+. На это указывает чувствительность процесса к веществам, повышающим проницаемость мембраны для протонов и делающим, таким образом, невозможным образование протонного градиента, а также к ингибиторам мембрансвязанной протонной АТФ-синтазы.
Последний этап, заключающийся в акцептировании сульфатом электронов с помощью серии редуктаз, представляет собой собственно диссимиляционную сульфатредукцию.
Известно восстановление сульфата до сульфида, входящего в состав серосодержащих аминокислот (цистин, цистеин, метионин), в конструктивном метаболизме большинства эубактерий. Оно имеет место всегда при выращивании бактерий на среде, где источником серы служат сульфаты. Активность процесса ограничена потребностями клетки в серосодержащих компонентах, а они невелики. Ассимиляция сульфата начинается с его активирования с помощью АТФ в реакции, катализируемой АТФ-зависимой сульфурилазой:
SO42– + 2H+ + АТФ ® АФС + ФФ,
где АФС — аденозинфосфосульфат, а ФФ — пирофосфат.
У многих бактерий аденозинфосфосульфат подвергается еще одному фосфорилированию с участием АТФ, в результате которого образуется фосфоаденозинфосфосульфат. Затем аденозинфосфосульфат (или его фосфорилированное производное) восстанавливается с образованием сульфита в реакции, катализируемой соответствующей редуктазой:
АФС + 2е – ® АМФ + SO32 – .
Последующее восстановление сульфита до сульфида осуществляется с помощью ассимиляционной сульфитредуктазы, катализирующей перенос 6 электронов на сульфит без образования каких-либо свободных промежуточных соединений:
SO32 – + 6e– + 6H+ ® S2– + 3H2O.
Основные отличия диссимиляционной сульфатредукции от ассимиляционной сводятся к следующему: диссимиляционное восстановление сульфата присуще только узкому кругу высокоспециализированных эубактерий: активность процесса диссимиляционной сульфатредукции намного выше, чем ассимиляционной, следствием чего является накопление в среде больших количеств H2S; наконец, различны механизмы обоих процессов.
До стадии образования аденозинфосфосульфата и его последующего восстановления до сульфита оба процесса идут одинаково. Механизм восстановления SO32 – до H2S при диссимиляционной сульфатредукции до конца не выяснен. Обсуждаются два пути. Согласно первому из них восстановление сульфита до сульфида (как и при ассимиляционном восстановлении сульфата) катализируется одним ферментом. Более вероятен второй путь, по которому этот процесс протекает трехступенчато с участием сульфит-, тритионат- и тиосульфатредуктазы и сопровождается образованием тритионата (S3O62 – ) и тиосульфата (S2O32 – ) в качестве свободных промежуточных продуктов:
3SO32– + 2e– ® S3O62 – ; (1)
3S3O62– + 2e– ® S2O32– + SO32 – ; (2)
3S2O32– + 2e– ® S2– + SO32–; (3)
При этом в реакциях 2 и 3 регенерируется сульфит, служащий субстратом реакции 1.
Не исключено, что у разных представителей группы восстановление сульфита до сульфида происходит по одно- или трехступенчатому пути.
У сульфатвосстанавливающих эубактерий обнаружены 3 типа сульфитредуктаз, участвующих в диссимиляционных процессах. Все они содержат сходные простетические группы, имеющие гемоподобную структуру и названные сирогемом. Простетические группы в белковом комплексе находятся в разном окружении, что и приводит к различиям в спектральных свойствах сульфитредуктаз. Подобные простетические группы не найдены в ферментах какого-либо иного типа.
Как можно видеть из разобранного выше процесса, окисление H2, сопряженное с восстановлением SO42 – до H2S, происходит с образованием и потреблением полезной энергии. (Последнее имеет место при активировании сульфата.) Поэтому для общего положительного энергетического баланса необходимо, чтобы перенос электронов сопровождался функционированием не менее 2 генераторов DmH+. При использовании в качестве энергетических субстратов органических соединений в присутствии сульфата часть АТФ может синтезироваться в реакциях субстратного фосфорилирования, внося определенный вклад в общий энергетический метаболизм этих бактерий.
Сульфатвосстанавливающие эубактерий широко распространены в анаэробных зонах водоемов разного типа, почвах и пищеварительном тракте животных. Часто они развиваются вместе с пурпурными и зелеными серобактериями, использующими в качестве донора электронов возникающий при сульфатредукции сероводород. Сульфатвосстанавливающим эубактериям принадлежит ведущая роль в образовании сероводорода в природе, в отложении сульфидных минералов. Накопление в среде H2S часто приводит к отрицательным последствиям: в водоемах — к гибели рыбы, в почвах — к повреждению растений. С активностью сульфатвосстанавливающих эубактерий связана также коррозия в анаэробных условиях различного металлического оборудования.
ГРУППЫ ХЕМООРГАНОТРОФНЫХ ЭУБАКТЕРИЙ
Большинство эубактерий используют в качестве источника энергии различные органические соединения, осуществляя их полное окисление до CO2 и H2O. Функционирующие у них системы извлечения энергии из органических субстратов состоят из нескольких взаимосвязанных механизмов. Рассмотрим пути, приводящие к получению энергии, на примере одного из представителей этой группы — Е. coli. Основное количество сахаров (~70%) катаболизируется у Е. coli по гликолитическому пути, в результате чего из 1 молекулы глюкозы образуются по 2 молекулы пирувата, АТФ и НАД-H2. Превращение остального количества сахара осуществляется по окислительному пентозофосфатному циклу, один оборот которого приводит к синтезу 1 молекулы пентозофосфата, 2 молекул НАДФ-H2 и выделению 1 молекулы CO2. Наконец, ряд субстратов (глюконовая, маннановая, гексуроновые кислоты) метаболизируются по пути Энтнера–Дудорова, что приводит к образованию 2 молекул пирувата и по 1 молекуле АТФ, НАД-H2 и НАДФ-H2.
Молекулы пирувата после их окислительного декарбоксилирования поступают в ЦТК, где происходит их полное окисление, приводящее к выделению 2 молекул CO2, синтезу 3 молекул НАД-H2 и 1 молекулы ФАД-H2. В отличие от гликолиза и пути Энтнера — Дудорова окислительный пентозофосфатный цикл может обеспечить полное окисление исходного субстрата. Вторая особенность этого пути — отсутствие реакций, сопряженных с синтезом АТФ по механизму субстратного фосфорилирования.
Таким образом, функционирование гликолиза и пути Энтнера — Дудорова совместно с ЦТК, а также окислительного пентозофосфатного цикла приводит к полному окислению исходных субстратов углеводной природы. Электроны с переносчиков поступают в дыхательную цепь (см. рис. 95, В) и в зависимости от условий могут передаваться на молекулярный кислород или другие конечные акцепторы (фумарат, нитрат). Кроме того, Е. coli в анаэробных условиях в отсутствие подходящего акцептора может получать энергию, осуществляя брожение, основным продуктом которого является этанол.
Если исходными субстратами служат не сахара, а вещества другой химической природы, их превращение на первом этапе приводит к возникновению соединений, которые в дальнейшем катаболизируются по одному из основных описанных выше путей.
Биохимическое изучение широкого круга дышащих хемоорганотрофных эубактерий показало, что функционирующие у них системы получения энергии в принципе аналогичны описанной выше, различаясь определенными деталями: наличием одного или больше катаболических путей, составом переносчиков дыхательной цепи, природой используемых конечных акцепторов электронов и т. д. Складывается впечатление, что природа, создавая наиболее совершенную систему извлечения энергии из органических субстратов, на уровне прокариот опробовала сочетание разных механизмов, прежде чем остановиться на чем-то определенном.
У эубактерий, использующих органические соединения в качестве доноров электронов, мы также встречаемся с такими способами получения энергии, которые у высших форм жизни не встречаются. Остановимся на некоторых группах эубактерий, характеризующихся специфическими типами энергетических процессов.
Метилотрофы
Среди прокариотных и эукариотных микроорганизмов довольно широко распространена способность использовать для роста многие соединения, содержащие один атом углерода, более восстановленные, чем CO2, а также соединения, содержащие больше одного углеродного атома, но не имеющие С-С-связей. К веществам первого типа относятся окись углерода (CO), метан (CH4), метанол (CH3OH), формальдегид (HCOH), муравьиная кислота (HCOOH), метиламин (CH3NH2), хлорметан (CH3Cl), цианистый калий (KCN) и др. Примером соединений второго типа служат ди- и триметиламины [(CH3)2NH, (CH3)2N], диметилсульфид [(CH3)2S], метилформиат (CH3COOH)68 и др. Обычно такие соединения называются одноуглеродными, или C1-соединениями. В большинстве из них углерод представлен в виде метильной группы, поэтому микроорганизмы, использующие эти соединения, получили название метилотрофов.
68 Структурная формула метилформиата:
Использовать C1-соединения могут многие аэробные и анаэробные прокариоты. Среди анаэробов такой способностью обладают, например, сульфатвосстанавливающие эубактерий, метанобразующие архебактерии, многие типичные хемо- и фототрофные эубактерии. К метилотрофам относят облигатно аэробные эубактерии, обладающие способностью использовать в качестве единственного источника углерода и энергии одноуглеродные соединения. Круг таких организмов широк. Это различные грамположительные и грамотрицательные формы — представители Pseudomonas, Bacillus, Hyphomicrobium, Protaminobacter, Arthrobacter, Nocardia и др.
В отношении способа питания различают две основные группы метилотрофов: факультативные и облигатные. Факультативные метилотрофы наряду с одноуглеродными могут использовать и некоторые полиуглеродные соединения. Группа облигатных метилотрофов включает эубактерии, использующие только одноуглеродные соединения.
В IX издании Определителя бактерий Берги облигатные и факультативные метилотрофы выделены в семейство Methylococcaceae, включающее роды Methylococcus и Methylomonas. Основной признак, принятый во внимание при выделении в это семейство, — способность использовать метан в качестве единственного источника углерода и энергии в аэробных или микроаэробных условиях.
Метилотрофы, отнесенные к семейству Methylococcaceae, грамотрицательные эубактерии с разной морфологией и размерами клеток, подвижные или неподвижные. Некоторые штаммы образуют цисты. Характерной особенностью при росте на метане является наличие в клетке развитой системы внутрицитоплазматических мембран, которые могут быть разделены на два типа: внутрицитоплазматические мембраны I типа представлены стопками плотно упакованных везикулярных дисков, распределенных по всей цитоплазме; внутрицитоплазматические мембраны II типа имеют вид ламелл, расположенных по периферии клетки.
Помимо метана в качестве единственного источника углерода и энергии облигатные метилотрофы могут использовать метанол, формальдегид и другие C1-соединения, а факультативные — также C2-, C4-кислоты, этанол, глюкозу. Использование метилотрофами C1-соединений в конструктивном и энергетическом метаболизме привело к формированию у них специфических путей ассимиляции и диссимиляции этих соединений.
Процесс полного окисления метана может быть представлен в виде следующей схемы (рис. 99).
Первый этап — окисление метана до метанола катализируется метанмонооксигеназой в реакции:
CH4 + O2 + H2A ® CH3OH + A + H2O.
где O2 — молекулярный кислород, а H2A — восстановитель. Из приведенной реакции становится понятной облигатная зависимость окисления метана от молекулярного кислорода.
Описаны две формы метанмонооксигеназы: связанная с внутрицитоплазматическими мембранами и растворимая. Донором электронов для первой предположительно может быть восстановленный цитохром с или НАД-H2, образующийся в результате обратного электронного транспорта, для второй — только НАД(Ф)-H2 или соединения, которые окисляются с его образованием. Остальные этапы окисления катализируются соответствующими дегидрогеназами, различающимися строением, природой акцепторов электронов и другими параметрами.
|
| Рис. 99. Окисление метана и связь энергетического и конструктивного метаболизма у метилотрофов: Ф1 — метанмонооксигеназа; Ф2 — метанолдегидрогеназа; Ф3 — формальдегиддегидрогеназа; Ф4 — формиатдегидрогеназа; ассимиляционные циклы: 1 — рибулозомонофосфатный, 2 — сериновый, 3 — восстановительный пентозофосфатный |
Формальдегид у метилотрофов является ключевым метаболитом, на уровне которого расходятся конструктивные и энергетические пути. Часть формальдегида превращается в вещества клетки по специфическим для этих эубактерий ассимиляционным циклическим путям, большая часть окисляется до CO2 в линейной последовательности реакций через формиат.
Дыхательные цепи метилотрофов по составу переносчиков и их локализации на мембране похожи на таковые большинства аэробных эубактерий, что предполагает возможность функционирования у них трех пунктов сопряжения. В окислитель-ком метаболизме C1-соединений участвуют НАД, флавины, хиноны, цитохромы типа b, c, a, o.
Этап окисления метана до метанола, катализируемый оксигеназным ферментом, не связан с получением клеткой энергии. Энергетическая эффективность окисления C1-соединений соответствующими дегидрогеназами определяется местом поступления электронов в дыхательную цепь. Окисление метанола до формальдегида, катализируемое ферментом, содержащим в качестве простетической группы особый хинон, сопровождается передачей электронов в дыхательную цепь на уровне цитохрома c. Это приводит к синтезу одной молекулы АТФ, т. е. указывает на функционирование только третьего пункта сопряжения (см. рис. 96).
Окисление формальдегида и формиата, зависимое от НАД, позволяет предполагать, что перенос пары электронов может быть связан с тремя трансмембранными перемещениями протонов. Полученные экспериментальные данные указывают, однако, на меньшие выходы АТФ. Вопрос о том, на каком уровне передаются электроны от формальдегида и формиата в дыхательную цепь, не вполне ясен.
У метилотрофов функционируют циклические пути ассимиляции C1-соединений, ответственные за превращения их в вещества клетки: восстановительный пентозофосфатный, рибулозомонофосфатный и сериновый. В восстановительном пентозофосфатном цикле (см. рис. 77) происходит ассимиляция CO2, образующейся при окислении C1-соединений. У метилотрофов этот путь не имеет широкого распространения и обнаружен только у представителей, способных расти автотрофно, а также у тех, кто может использовать формиат.
В рибулозомонофосфатном и сериновом циклах обеспечивается использование в биосинтетических процессах формальдегида, образуемого при окислении разных C1-соединений. Первая реакция рибулозомонофосфатного пути — акцептирование формальдегида молекулой рибулозо-5-фосфата, приводящее к образованию гексулозо-6-фосфата, который изомеризуется затем во фруктозо-6-фосфат (рис. 100, А). Ферменты, катализирующие обе реакции, специфичны для данного цикла. Далее возможны разные варианты. По одному из них фруктозо-6-фосфат подвергается фосфорилированию. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две триозы: 3-фосфоглицериновый альдегид и фосфодиоксиацетон. 3-ФГА и фруктозо-6-фосфат участвуют в серии реакций, приводящих к регенерации акцептора формальдегида — рибулозо-5-фосфата. Эти реакции аналогичны таковым восстановительного пентозофосфатного цикла (см. рис. 77). Три оборота рибулозомонофосфатного цикла приводят к синтезу молекулы фосфодиоксиацетона, используемого в биосинтетических процессах.
Сериновый цикл существенно отличается от предыдущего пути ассимиляции формальдегида природой интермедиатов и ферментами (рис. 100, Б). Ключевая реакция этого пути — конденсация формальдегида и глицина в присутствии тетрагидрофолиевой кислоты, приводящая к образованию серина. Последний в реакции трансаминирования превращается в оксипировиноградную кислоту, последовательное восстановление и фосфорилирование которой приводит к образованию 3-ФГК. Одна часть 3-ФГК используется для синтеза вещества клетки, другая превращается в фосфоенолпировиноградную кислоту. Последующее карбоксилирование ФЕП приводит к синтезу молекулы щавелевоуксусной кислоты. Эта реакция примечательна тем, что в сериновый цикл вовлекается CO2. Последующая серия реакций приводит к регенерированию глицина, и цикл замыкается.
Ассимиляция формальдегида через рибулозомонофосфатный цикл характерна для метилотрофов, имеющих мембранную организацию I типа, а через сериновый — для метилотрофов с системой внутрицитоплазматических мембран II типа.
|
| Рис. 100. Пути ассимиляции формальдегида метилотрофами. А — рибулозомонофосфатный цикл: Ф1 — гексулозофосфатсинтаза; Ф2 — фосфогексулозоизомераза; Ф3 — фосфофруктокиназа; Ф4 — фруктозодифосфатальдолаза; прерывистой линией обозначены реакции регенерации рибулозо-5-фосфата, аналогичные соответствующим реакциям, изображенным на рис. 77. Б — сериновый цикл: Ф1 — сериноксиметилтрансфераза; Ф2 — серинглиоксилатаминотрансфераза; Ф3 — оксипируватредуктаза; Ф4 — глицераткиназа; Ф5 — енолаза; Ф6 — ФЕП-карбоксилаза; Ф7 — малатдегидрогеназа; Ф8 — малаттиокиназа; Ф9 — малил-КоА-лиаза |
ЦТК в системе катаболических путей не занимает ведущего места. У ряда облигатных метилотрофов он не "замкнут" (см. рис. 85). Если даже содержит все ферменты, активность некоторых из них невысока.
Изучение этой специфической группы эубактерий привело к заключению о ее близости к автотрофам. Это проявляется как в способности метилотрофов синтезировать все вещества клетки из С1-соединений, так и функционированию развитого у них механизма ассимиляции CO2 в восстановительном пентозофосфатном цикле.
Одноуглеродные соединения, в первую очередь метан, широко распространены в природе. Метан — конечный продукт жизнедеятельности одной из групп архебактерий, отход ряда промышленных процессов, основной компонент газов геохимического происхождения. Метанол — один из продуктов разложения пектинов, осуществляемого в природе с участием разнообразных микроорганизмов. Формиат — довольно распространенный продукт сбраживания углеводов и других углеродных субстратов. Метанол, формальдегид, формиат — отходы разнообразных химических процессов, осуществляемых в крупных масштабах. Однако в биосфере метан и другие С1-соединения поддерживаются на постоянном уровне главным образом за счет деятельности метилотрофов.
Метилотрофы — обитатели водоемов и почв различного типа, где идут процессы с образованием одноуглеродных соединений. Их выделяют из сточных вод, с гниющих растительных остатков, из рубца жвачных животных. Интерес к изучению метилотрофов связан не только с особенностями их метаболизма, но и с перспективами их практического использования: метилотрофы характеризуются активным ростом, высокими выходами биомассы, большим содержанием полноценного белка в клетке; являются эффективными продуцентами различных веществ.
Уксуснокислые бактерии
Уксуснокислые бактерии, выделенные в роды Gluconobacter и Acetobacter, могут получать энергию, осуществляя неполное окисление ряда органических соединений. Это грамотрицательные бесспоровые палочки, слабоподвижные за счет перитрихиально или полярно расположенных жгутиков, или неподвижные. Облигатные аэробы. Довольно требовательны к субстратам для роста. Почти все виды нуждаются в отдельных витаминах, в первую очередь в пантотеновой кислоте, однако есть формы, способные к синтезу всех факторов роста.
К числу окисляемых соединений относятся одноатомные спирты, содержащие от 2 до 5 углеродных атомов, а также многоатомные спирты — производные сахаров. Окисление первичных спиртов приводит к образованию кислот. Например, этанол с помощью соответствующих дегидрогеназ окисляется до ацетата:
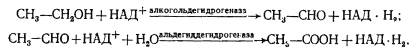
Вторичные спирты окисляются до кетонов:
CH3-CHOH-CH3 ® CH3-CO-CH3.
Многоатомные спирты окисляются этими бактериями в альдозы и кетозы, например: сорбит ® сорбоза; глицерин ® диоксиацетон. Альдозы и кетозы могут далее окисляться в соответствующие кислоты. Метаболизирование cахаров осуществляется по окислительному пентозофосфатному пути.
Круг окисляемых соединений различен для разных представителей, входящих в эту группу. С точки зрения характеристики энергетических возможностей уксуснокислых бактерий важно подчеркнуть, что у них развилась удивительная способность воздействовать на определенные химические группировки" осуществляя их одно- или двухступенчатое окисление. Наиболее характерна способность этих бактерий окислять этиловый спирт в уксусную кислоту, давшая название всей группе в целом.
Дальнейшая судьба полученных в результате неполного окисления продуктов различна. Некоторые уксуснокислые бактерии не способны к последующим превращениям образовавшихся соединений, и их окислительные способности, следовательно, весьма ограничены. Эти бактерии, объединенные в род Gluconobacter (единственный вид G. oxydans), глюкозу окисляют до глюконовой кислоты, этанол — только до ацетата, который дальше не может ими окисляться из-за отсутствия "замкнутого" ЦТК.
Вторую группу составляют бактерии, способные к полному окислению органических субстратов до CO2 и H2O. В этом случае образовавшаяся уксусная кислота представляет собой лишь промежуточный этап, и после исчерпания из среды исходного субстрата бактерии начинают медленно окислять уксусную кислоту, включая ее в механизм конечного окисления — ЦТК. Бактерии этой группы объединены в род Acetobacter, типичным представителем которого является A. peroxydans.
Электроны от окисляемых субстратов поступают в дыхательную цепь и далее через систему переносчиков передаются на O2, служащий обязательным конечным акцептором электронов. Электронный транспорт приводит к генерированию DmH+.
Место включения электронов в дыхательную цепь определяется ферментом, катализирующим соответствующую окислительную реакцию. Если окисление катализируется НАД-зависимой дегидрогеназой, электроны (водород) передаются на НАД+ и с него на переносчики, локализованные на мембране, что открывает возможность для сопряжения электронного транспорта с тремя трансмембранными перемещениями протонов и, соответственно, синтезом 3 молекул АТФ. Недавно у представителей родов Acetobacter и Gluconobacter были обнаружены дегидрогеназы, содержащие в качестве простетической группы соединение из группы хинонов, способные принимать и отдавать 2 атома водорода. Хинонсодержащие дегидрогеназы локализованы на внешней стороне ЦПМ, где и происходит окисление этанола и других соединений. Электроны поступают в дыхательную цепь на уровне цитохромов, а протоны выделяются в периплазматическое пространство.
Уксуснокислые бактерии часто развиваются вслед за дрожжами, используя продукт спиртового брожения как субстрат для роста. Применяются в микробиологической промышленности для получения столового уксуса и в производстве аскорбиновой кислоты (на этапе окисления сорбита в сорбозу).
Аммонифицирующие бактерии
Аминокислоты и белки также могут выступать в качестве энергетических ресурсов для эубактерий. Их использование связано в первую очередь с определенными ферментативными преобразованиями подготовительного характера. Белки сначала вне клетки расщепляются протеолитическими ферментами, катализирующими разрыв определенных пептидных связей, на отдельные фрагменты — пептиды, которые затем поглощаются клеткой и расщепляются внутриклеточными протеолитическими ферментами до отдельных аминокислот. Дальнейшее их превращение возможно по нескольким направлениям: 1) аминокислоты непосредственно используются в конструктивном метаболизме для построения белковых молекул; 2) аминокислоты служат основным материалом в энергетических процессах. В последнем случае метаболизирование аминокислот начинается с их декарбоксилирования или дезаминирования.
В результате декарбоксилирования аминокислот образуется CO2 и первичные амины:
R-CHNH2-COOH ® R-CH2NH2 + CO2.
Наиболее известны из них путресцин и кадаверин, возникающие в результате декарбоксилирования орнитина и лизина при анаэробном разложении белка.
Дезаминирование — отщепление аминогруппы от аминокислоты, приводящее к выделению азота в виде аммиака, поэтому процесс распада белков, сопровождающийся образованием аммиака, получил название аммонификации. Судьба углеродного скелета аминокислоты при дезаминировании различна. Процесс может происходить при участии молекулярного кислорода:
R-CHNH2-COOH + 1/2O2 ® R-CO-COOH + NH3; (1)
с помощью НАД-зависимых дегидрогеназ:
R-CHNH2-COOH + НАД+ + H2O ® R-CO-COOH + НАД-H2 + NH3, (2)
или в форме гидролиза:
H2N-CO-NH2 + H2O ® 2NH3 + CO2. (3)
Дезаминирование, при котором происходят окислительные (примеры 1, 2) или гидролитические (пример 3) преобразования углеродного скелета аминокислот, получило название окислительного или гидролитического дезаминирования соответственно.
При дезаминировании некоторых аминокислот (аланина, аспарагиновой, глутаминовой кислот) образуются a-кетокислоты (пировиноградная, a-кетоглутаровая, щавелевоуксусная), принадлежащие к числу промежуточных продуктов клеточного катаболизма. Большинство же возникающих при этом органических кислот подвергается сначала предварительным превращениям, приводящим к появлению соединений, способных прямо включаться в основные катаболические пути клетки. Например, распад L-лейцина в конечном итоге приводит к образованию ацетил-КоА — исходного субстрата ЦТК. Такова энергетическая сторона метаболизма бактерий-аммонификаторов.
Использование в качестве источника углерода и энергии аминокислот требует от организмов соответствующего набора ферментов, катализирующих протеолиз белков и пептидов и дезаминирование всего набора аминокислот. Для аммонификаторов вообще характерно использование широкого круга органических соединений, в том числе сахаров, органических кислот, которые, как правило, они предпочитают белкам. Форм, приспособленных к использованию только белков, немного.
Эта группа представлена в основном грамположительными споровыми палочками, входящими в состав рода Bacillus (В. subtilis, В. megatherium). Из бесспоровых форм в группу аммонификаторов входят представители родов Pseudomonas, Micrococcus, Arthrobacter, Mycobacterium, Proteus.
Процесс аммонификации в быту известен как "гниение", поскольку при этом происходит накопление продуктов, обладающих неприятным специфическим запахом: сероводорода, метилмеркаптана, первичных аминов, известных под названием "трупных ядов". Роль гнилостных бактерий в природе огромна. Доля белка в тканях умерших животных и растений велика, и аммонификаторы осуществляют минерализацию белков, разлагая их в конечном итоге до CO2, NH3 и H2S.
Бактерии, разрушающие целлюлозу
Целлюлоза — полисахарид, являющийся главным компонентом клеточных стенок высших растений и водорослей. Ее синтез по своим масштабам превосходит синтез всех остальных природных соединений, так что (наряду с крахмалом) целлюлоза — самое распространенное на Земле органическое соединение.
В то же время химическое строение целлюлозы таково, что делает ее материалом, инертным ко многим воздействиям. Целлюлоза — полимер, состоящий из цепочек молекул b-D-глюкозы, соединенных b-1,4-гликозидными связями. Цепочки в свою очередь объединены в пучки (волокна). Волокна организованы таким образом, что гидрофильные группы целлюлозных цепочек защищены от внешних воздействий. Волокна, кроме того, окружены оболочкой, в состав которой входят воск и пектин. Все это придает целлюлозным волокнам механическую прочность, делает их не растворимыми в воде и устойчивыми к различным химическим воздействиям.
Разлагать целлюлозу в анаэробных и аэробных условиях способны эубактерии, относящиеся к разным таксономическим группам: отдельные представители рода Clostridium, ряд актиномицетов, миксобактерии, некоторые бактерии рода Pseudomonas, из коринеформных бактерий представители рода Cellulomonas, постоянные обитатели желудка жвачных животных, относящиеся к родам Ruminicoccus, Bacteroides, Butyrivibrio и др. Единственное, что объединяет эти организмы, — способность синтезировать ферменты, расщепляющие целлюлозу.
Ферментативное разложение целлюлозы осуществляется с помощью целлюлазного комплекса и состоит из нескольких этапов. Сначала эндо-b-1,4-глюканаза разрывает гликозидные связи внутри целлюлозной цепочки, что приводит к образованию довольно крупных фрагментов со свободными концами. Затем экзо-b-1,4-глюканаза катализирует отщепление от конца цепочки дисахарида целлобиозы. И, наконец, последняя гидролизуется до глюкозы с помощью b-глюкозидазы.
Ферменты, входящие в состав целлюлазного комплекса, могут выделяться в окружающую среду или оставаться связанными с клеточной поверхностью. В первом случае целлюлоза с помощью экзогенных глюканаз может расщепляться до целлобиозы. Во втором случае никаких внеклеточных целлюлаз и промежуточных продуктов расщепления целлюлозы в окружающей среде не обнаруживается. H2 поверхности бактериальной клетки найдены сферические частицы — центры целлюлолитической активности, получившие название целлюлосом, состоящие из полипептидных субъединиц (комплекс целлюлазных ферментов) и углеводных фибрилл.
Разложение целлюлозы в аэробных условиях приводит к последующему метаболизированию глюкозы в системе катаболических процессов (гликолиз ® ЦТК) с поступлением водорода (электронов) в дыхательную цепь и переносу их на O2.
Бактериям, использующим целлюлозу, принадлежит огромная роль в природе, так как именно им мы обязаны разложением клетчатки, составляющей основную массу всех синтезируемых природных соединений.
Денитрифицирующие бактерии
У многих эубактерии конечным акцептором электронов дыхательной цепи, наиболее часто заменяющим молекулярный кислород, служит нитрат. Он может восстанавливаться до нитрита, накапливающегося в среде, или молекулярного азота, удаляющегося в атмосферу. Процесс восстановления нитрата до нитрита в системе энергетического метаболизма, получивший название нитратного дыхания, широко распространен среди эубактерии и обнаружен у представителей более 70 родов.
Гораздо уже круг организмов, способных восстанавливать нитраты или нитриты до N2. H2 этом пути в качестве промежуточных продуктов идентифицированы окись (NO) и закись (N2O) азота:
NO3– ® NO2– ® NO ® N2O ® N2.
Как и молекулярный азот, NO и N2O — газообразные продукты.
Процесс восстановления NO3 – или N2O до какой-либо из газообразных форм азота получил название денитрификации. К денитрификации способны только прокариоты. Значение процесса — генерирование АТФ в анаэробных условиях, используя для акцептирования электронов, поступающих в дыхательную цепь, восстановление NO3 – или NO2 – . Наиболее распространенные формы денитрификации — восстановление NO3 – или NO2 – до N2. Встречаются также штаммы, осуществляющие отдельные этапы процесса: NO3 – ® N2O, N2O или NO ® N2. "Полная" или "усеченная" денитрификация обнаружена у эубактерии, принадлежащих ко всем основным физиологическим группам: фототрофам и хемолитотрофам, грамположительным и грамотрицательным факультативным анаэробам. В наибольшей степени способность к денитрификации распространена у бактерий из родов Bacillus и Pseudomonas.
Свойство восстанавливать нитрат представляется менее необычным, если вспомнить, что бактерии, использующие в качестве источника азота нитраты (а таких много), должны иметь ферментную систему для его восстановления, так как в конструктивном метаболизме азот участвует только в восстановленной форме. Таким образом, восстановление нитрата в системе реакций конструктивного метаболизма, получившее название ассимиляционной нитратредукции (NO3– ® NH3), очевидно. Оно имеет место всегда при выращивании на среде с нитратами в качестве единственного источника азота.
Способность к ассимиляционной нитратредукции необязательно облигатно связана со способностью к денитрификации. Например, Pseudomonas aeruginosa обладает обеими метаболическими активностями; у Rhodopseudomonas sphaeroides обнаружена способность к денитрификации, но не к ассимиляции нитрата; наконец, многие эубактерии могут ассимилировать нитрат, но не могут осуществлять денитрификацию. Оба процесса восстановления нитрата различаются по ряду признаков (табл. 32). Информация об ассимиляционной нитратредукции и денитрификации закодирована в разных генах.
Таблица 32. Различия между ассимиляционной нитратредукцией и денитрификацией
| Признак | Ассимиляционная нитратредукция | Денитрификация |
| Локализация в клетке | в цитоплазме | в мембранах |
| Отношение к энергетическому метаболизму | не связана с получением клеточной энергии | связана с синтезом АТФ |
| Отношение к O2 | нечувствительна к O2 | O2 ингибирует активность и репрессирует синтез NO2–- и NO3–-редуктаз |
| Отношение к NH3 | репрессирует синтез ферментов | |
| Судьба конечного продукта | входит в состав азотсодержащих клеточных компонентов | выделяется из клетки |
Большинство денитрификаторов — хемоорганотрофы. Использование в качестве конечного акцептора электронов нитратов позволяет им окислять органические субстраты полностью (до CO2 и H2O) по обычным катаболическим путям. Переходящий на переносчики водород поступает в дыхательную цепь.
Изменение свободной энергии при окислении 1 молекулы глюкозы молекулярным кислородом (DG0' = – 2870 кДж/моль) того же порядка, что и окисление этого же субстрата в анаэробных условиях нитратом, восстанавливающимся до нитрита (DG0' = — 1770 кДж/моль) или молекулярного азота (DG0' = — 2700 кДж/моль). Таким образом, энергетические возможности процесса окисления глюкозы с участием нитрата сопоставимы с энергетическими возможностями процесса аэробного дыхания. Запасание клеткой полезной энергии при денитрификации зависит от организации электронного транспорта, свойств и локализации соответствующих редуктаз. Электронтранспортные цепи денитрификаторов в анаэробных условиях содержат все основные типы связанных с мембранами переносчиков: флавопротеины, хиноны (убихинон, менахинон или нафтохинон), цитохромы типа b, c. Цитохромоксидазы в этих условиях не синтезируются.
Полный процесс денитрификации состоит из 4 восстановительных этапов, каждый из которых катализируется специфической мембрансвязанной редуктазой. Нитратредуктазы всех денитрификаторов структурно сходны между собой (содержат Мо-FeS-белки) и катализируют восстановление нитрата до нитрита в соответствии с уравнением:
NO3– + 2e – + 2H+ ® NO2– + H2O.
С дыхательной цепью нитратредуктазы сопряжены на уровне цитохрома b (см. рис. 98, Б).
Нитритредуктазы (1) и, вероятно, редуктазы окиси (2) и закиси (3) азота акцептируют электроны на уровне цитохрома с, осуществляя следующие реакции:
NO2 – + e– + H+ ® NO + OH–; (1)
2NO + 2e – + 2H+ ® N2O + H2O; (2)
N2O + 2e– + 2H+ ® N2 + H2O. (3)
В дыхательной цепи денитрификаторов при переносе электронов на нитрат функционируют 2 генератора DmH+ (вместо 3 при переносе электронов на O2). Процесс восстановления нитрата до нитрита локализован на внутренней стороне ЦПМ. По другим данным, ферментный комплекс имеет трансмембранную ориентацию в результате чего поглощенные из цитоплазмы протоны переносятся на противоположную сторону, где участвуют в нитратредуктазной реакции. В любом из вариантов это приводит к созданию трансмембранного протонного градиента нужного направления (см. рис. 25). Таким образом, при денитрификации перенос 2 электронов сопряжен с трансмембранным переносом 4 протонов, т. е. энергетический выход составляет примерно 70% сравнительно с аэробным дыханием.
Все денитрифицирующие бактерии — факультативные анаэробы, переключающиеся на денитрификацию только в отсутствие O2, поэтому, вероятно, их приспособление к анаэробным условиям — вторичного происхождения. Способность к денитрификации развилась после сформирования механизмов использования Од как конечного акцептора электронов. Первым шагом на пути вторичного приспособления к анаэробным условиям явилось развитие нитратного дыхания. Следующий шаг — совершенствование способности использовать нитраты для акцептирования электронов дыхательной цепи — привел к возникновению денитрификации.
Денитрифицирующие бактерии — обитатели пресных и морских водоемов, почв разного типа, в связи с чем денитрификация широко распространена в природе. Этот процесс служит источником атмосферного азота, являясь необходимым звеном в круговороте азота в природе. В то же время денитрификация имеет отрицательное значение, так как приводит к обеднению почв азотом. Потери азотных удобрений в почвах в результате денитрификации могут составлять от 5 до 80%. Один из способов борьбы с денитрификацией — рыхление почвы, создающее в ней аэробные условия, что заставляет денитрифицирующие бактерии перестраивать электронтранспортные системы, осуществляя перенос электронов на O2, а не на нитраты.
М.В.Гусев, Л.А.Минеева © 1992-2001
Кафедра клеточной физиологии и иммунологии биологического факультета МГУ им. М.В.Ломоносова © 2000-2001
Страница обновлена 09.09.01
Оформление: А.В.Киташов