| i | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | ↑ |
Глава 32
Молекулярная эволюция
Существует несколько биохимических методов, позволяющих количественно измерить изменения, происшедшие в гомологичных макромолекулах близко- или отдаленнородственных видов в процессе их дивергенции. Объектом таких исследований служат обычно белковые молекулы, молекулы ДНК, но иногда и другие вещества, например вторичные метаболиты растений. Молекулярные данные проливают свет на филогенетические взаимоотношения. Они породили также некоторые полезные дискуссии, которые мы здесь вкратце обсудим1.
Методы
Главными методами изучения молекулярной эволюции служат: гибридизация ДНК, иммунологические тесты (используемые для определения групп крови), определение последовательности аминокислот (для гемоглобина, миоглобина, цитохрома с и т. п.), секвенирование ДНК, электрофорез (для различных ферментов) и биохимическая систематика (использующая разного рода вторичные метаболиты растений).
Непосредственные результаты сравнительно-биохимического изучения макромолекул можно выразить количественно несколькими различными способами. Среди таких способов, позволяющих измерять степень биохимической дифференциации между разными филогенетическими линиями, отметим следующие: оценка относительной степени сродства между цепями ДНК из организмов разных видов (при исследованиях методом гибридизации ДНК); определение числа и доли замещений аминокислот в гомологичных полипептидных цепях (при изучении аминокислотных последовательностей белков); определение вероятного числа точковых мутаций, участвующих в создании наблюдаемых различий между гомологичными белками (путем экстраполяции данных об аминокислотных последовательностях белков); определение доли ферментных локусов, различающихся по электрофоретичееким свойствам (при исследовании методом электрофореза).
Представляют также интерес косвенные результаты биологических исследований. Количественная мера биохимической дифференциации между ныне живущими видами А, В, С, D независимо от того, какая именно используется мера, может быть наложена на филогенетическое древо, ветви которого заканчиваются видами А, В, С, D. Известное или выведенное геологическое время, прошедшее после дивергенции соответствующих ветвей, служит знаменателем. Сопоставляя эти две меры, мы получим количество изменения, происходящего на макромолекулярном уровне за единицу времени, или скорость молекулярной эволюции.
Различия в последовательностях аминокислот
Сходства и различия в последовательностях аминокислот в полипептидных цепях гомологичных белков, принадлежащих разным видам, могут служить определённой и количественной мерой степени молекулярной дифференциации. Сейчас уже собрано множество данных о гомологичности молекул гемоглобина, миоглобина, цитохрома с, иммуноглобулина и других белков (см. интересные обзоры Dayhoff, 1968, 1969, 1972, 1978*). Здесь мы рассмотрим лишь несколько типичных примеров.
Гемоглобин взрослого человека состоит из двух идентичных полипептидных α-цепей, двух идентичных (β-цепей и присоединенных к ним групп тема. Каждая α-цепь содержит по 141 аминокислоте, а каждая β-цепь—по 146. В гемоглобине здорового человека каждое положение в цепи занято определённой аминокислотой. Последовательность аминокислот известна. Один ген детерминирует последовательность аминокислот в α-цепях, а другой, отдельный, ген — их последовательность в β-цепях. Отметим попутно один интересный факт: хотя α- и β-цепи гемоглобина человека различаются между собой, их аминокислотные последовательности сходны и, вероятно, возникли в результате дивергенции от какой-то общей предковой полипептидной цепи (Ingram, 1963*).
между человеком и друдими млекопитающими | ||
| Пара видов. | Различия | |
| α-цепь | β-цепь | |
| Человек — шимпанзе | 0 | 0 |
| Человек — горилла | 1 | 1 |
| Человек — макак-резус | 3 | 5 |
| Человек — макак | 5–7 | – |
| Человек — мышь | 13–15 | 18 |
| Человек — кролик | 18 | 10 |
| Человек — собака | 16–17 | 10 |
| Человек — лошадь | 13 | 17 |
| Человек — лама | 16 | 14 |
| Человек — свинья | 13 | 16 |
| Человек — корова | 12 | 17 |
| Человек — овца | 15 | 18 |
| Человек — коза | 14–16 | 18–20 |
| Человек — гривистый баран | 15–16 | 21–23 |
| Человек — гиганский серый кенгуру | 19 | 26 |
Нас здесь больше интересует степень дифференциации гемоглобиновых цепей у разных видов. Возьмем в качестве эталона гемоглобин здорового взрослого человека. Число различий по аминокислотам между человеком и разными другими видами млекопитающих представлено в табл. 32.1, Как показывает эта таблица, у человека и у шимпанзе последовательности аминокислот и в α-, и в β-цепях идентичны. Гемоглобины человека и гориллы различаются лишь по двум аминокислотам, по одной в каждой цепи. Человек и обезьяны довольно близки друг к другу по строению гемоглобина. Различия в строении гемоглобина между человеком и представителями других отрядов млекопитающих гораздо шире — от 10 до 26% (табл. 32.1).
Гемоглобин человека отличается от гемоглобина лягушки и карпа сильнее, как и следовало ожидать. Различия в аминокислотной последовательности β-цепи между человеком и лягушкой составляют 46%, а различия в α-цепи между человеком и карпом — 50% (Dayhoff, 1972*).
Другой белок — дыхательный фермент цитохром с — локализован в митохондриях эукариотических организмов и очень удобен для сравнительно-биохимических исследований представителей разных типов и разных царств. В табл. 32.2 приведены некоторые данные относительно молекулярных различий по цитохрому с. Человек служит эталоном для одной группы сравнений, а дрозофила — для другой. Здесь снова можно отметить общую корреляцию между молекулярными различиями и степенью филогенетического родства.
Дейхоф (Dayhoff, 1969*) и её коллеги указывают, что наблюдаемое число различий в аминокислотном составе между гомологичными белками не обязательно должно быть равно числу аминокислот, действительно замещённых в процессе эволюционной дивергенции этих белков. В тех случаях, когда две полипептидные цепи различаются по многим аминокислотам, эволюционное расстояние может быть больше, чем наблюдаемые различия. Дейхоф и её коллеги предложили единицу эволюционного расстояния, названную ими РАМ-единицей (PAM-unit «accepted point mutations per 100 links», т. е. число фиксированных точковых мутаций на 100 звеньев цепи); эта единица должна служить для того, чтобы можно было дать скорректированную оценку эволюционной дивергенции на молекулярном уровне. Соотношение между наблюдаемым числом различий в аминокислотном составе на 100 звеньев цепи и эволюционным расстоянием, выраженным в РАМ-единицах, выглядит следующим образом (Dayhoff, 1969*):
| Число аминокис- лотных замен | РАМ-единицы |
| 1 | 1 |
| 5 | 5 |
| 10 | 11 |
| 25 | 31 |
| 50 | 83 |
| 75 | 208 |
| 85 | 370 |
Хьюбби и Трокмортон (Hubby, Throckmorton, 1965*) использовали электрофоретические методы для определения сходства или различия белков в группе Drosophila virilis. Было проведено сравнение многих белков и детерминирующих их генов для 10 видов, относящихся к этой группе (D. virilis, D. americana, D. texana и др.). Среди исследованных белков 60% оказались общими для всех видов этой группы. Несколько меньшая доля — белки, общие для близкородственных подгрупп. Остальная часть изученных белков специфична для каждого отдельного вида; эта доля равна 2.6% для D. virilis, 5.3% —для D. americana и достигает 28.2% для D. littoralis.
В другой серии работ, в которых использовался гель-электрофорез, 4 вида-двойника группы Drosophila willistoni сравнивали по 14—28 ферментным локусам (Ayala et al., 1970; Ayala, Tracey, 1974*). Оказалось, что эти виды различаются примерно по половине изучавшихся локусов.
Электрофоретические данные по нескольким или многим локусам для двух популяций или видов могут быть выражены через индекс, известный под названием показателя генетической идентичности (I) (Nei, 1972*). Этот показатель служит мерой доли идентичных генов у двух сравниваемых популяций или видов. Значения I лежат в пределах от 0 до 1; I=1 означает, что обе популяции содержат одни и те же аллели с одинаковыми частотами, а I = 0 — что у этих популяций нет общих аллелей (Nei, 1972*).
цитохрома С человека и других организмов. (по данным Dauhoff, 1969*) | |
| Виды | Число различий |
| Человек — макак-резус | 1 |
| Человек — лошадь | 12 |
| Человек — корова, овца | 10 |
| Человек — собака | 11 |
| Человек — кролик | 9 |
| Человек — курица, индейка | 13 |
| Человек — голубь | 12 |
| Человек — каймановая черепаха | 14 |
| Человек — гремучая змея | 13 |
| Человек — лягушка-бык | 17 |
| Человек — тунец | 20 |
| Человек — акула | 23 |
| Человек — дрозофила | 27 |
| Человек — мясная муха | 25 |
| Человек — бабочка (тутовый шелкопряд) | 29 |
| Человек — пшеница | 38 |
| Человек — Neurospora | 44 |
| Дрозофила — мясная муха | 2 |
| Дрозофила — бабочка (тутовый шелкопряд) | 14 |
| Дрозофила — пятиконечный бражник | 13 |
| Дрозофила — акула | 24 |
| Дрозофила — голубь | 23 |
| Дрозофила — пшеница | 42 |
Пример генетической идентичности близких видов у растений рода Tragopogon представлен в табл. 32.3 (Roose, Gottlieb, 1976*). В других родах растений часто встречаются пары видов со сходными значениями I, достигающими иногда 0.9 (см. Gottlieb, 1977*).
Широко распространено допущение, что электрофоретические методы дают надёжные оценки общего сходства или дивергенции между особями или группами. Обнаруженные такими методами различия по ферментным генам считают репрезентативными для генотипа в целом. Это допущение подразумевается в коэффициентах генетической идентичности и генетического расстояния (Nei, 1972*), которые приравнивают электрофоретическую меру дифференциации к генетической.
В некоторых случаях это допущение, по-видимому, оправданно. Так, Джейн и Сингх (Jain, Singh, 1979*) обнаружили хорошее совпадение электрофоретических данных, с одной стороны, и морфологических и цитогенетических показателей родства — с другой, между 15 видами овса (Avena).
Tragopodon (Compositae) (Roose, Gottlieb, 1976*) | |
| Пара видов | I |
| T. dubius — T. porrifolius | 0.50 |
| T. dubius — T. pratensis | 0.62 |
| T. porrifolius — T. pratensis | 0.53 |
Известно, однако, немало случаев несоответствия морфологических и электрофоретических данных. Примерами служат: среди животных рыбы Cyprinodon (Turner, 1974*), улитки Partula (Murray, Clarke 1980*) и гоминоиды (см. ниже); а среди растений— Hordeum (Giles, 1984*), Mimulus (Vickery, Willstein, 1987*), Tetramolopium (Crawford et al., 1987*) и Chenopodium (Walters, 1988*). В каждом из этих примеров морфологические различия между популяциями или видами довольно значительны, тогда как различия по ферментам, выявляемые методом электрофореза, невелики.
Подобные факты заставляют считать, что во многих недавних работах ценность электрофоретических данных для оценки эволюционных связей и филогении сильно преувеличивалась. Электрофоретические данные можно использовать в дополнение к морфологическим данным, но не вместо них. Такое мнение высказали Карсон (Carson, 1977*), Грант (Grant, 1977*), Мюррей и Кларке (Murray, Clarke, 1980*), Джайлз (Giles, 1984*), Викери и Вулстейн (Vickery, Willstein, 1987*).
Гибридизация ДНК
Методы гибридизации ДНК состоят в смешивании одноцепочечных фрагментов ДНК, полученных от двух разных видов. Доля в смеси общей ДНК, которая воссоединяется, образуя двухцепочечные спирали, и скорость воссоединения служат мерами степени генетического родства между данными видами.
Проиллюстрируем результаты, которые можно получить таким методом, на примере Drosophila. Drosophila melanogaster и D. simulans принадлежат к одной и той же группе видов. Доля их одноцепочечных ДНК, соединяющихся в двухцепочечную ДНК при проверке на гибридизацию, составляет 80%. D. funebris принадлежит к другому подроду, и при смешивании одноцепочечных фрагментов её ДНК и ДНК D. melanogaster или D. simulans в спаривании участвовало лишь 25% фрагментов (Laird, McCarthy, 1968*).
Метод гибридизации ДНК в настоящее время тщательно изучается (Lewin, 1988*), Молекулярные химики указывают на то, что спаривание одноцепочечной ДНК in vitro — сложный процесс, на который оказывают действие многие условия, и, следовательно, метод этот ненадежен, подобно лакмусовой пробе. Он даёт различные результаты в зависимости от конкретных условий его применения. Этот метод широко применяется зоологами, ботаниками и другими исследователями, но все они не являются специалистами-химиками, и их результаты в некоторых случаях могут оказаться не вполне надёжными. В будущем метод гибридизации ДНК, вероятно, придется стандартизировать более строго, после чего некоторые ранние исследования придется повторить.
Молекулярные взаимосвязи у гоминоидов
Для изучения родственных связей между человеком и человекообразными обезьянами используются различные молекулярные методы. Было установлено существование тесного иммунологического родства между этими организмами по группам крови системы АВО. У трёх видов человекообразных обезьян и у человека встречаются следующие группы крови:
| Человек | А, В, АВ, О |
| Гиббон | А, В, АВ |
| Орангутан | А, В, АВ |
| Шимпанзе | А, О |
Реакции агглютинации крови шимпанзе (Pan) и крови человека неразличимы; это относится и к гиббону (Hylobates). Горилла, однако, отличается от человека и других человекообразных обезьян и сходна по системе АВО с широконосыми обезьянами (Wiener, Moor-Jankowsky, 1971*).
Изучение аминокислотных последовательностей нескольких гомологичных белков человека и шимпанзе показало, что некоторые из этих белков полностью или почти полностью идентичны. Ниже перечислены гомологичные белки, различающиеся по одной аминокислоте или не различающиеся совсем.
| Гемоглобин | 0 |
| Цитохром с | 0 |
| Фибринопептид | 0 |
| Лизоцим | 0? |
| Δ-гемоглобин | 1 |
| Миоглобин | 1 |
Другие белки у этих двух видов различаются по нескольким аминокислотам; например, в сывороточном альбумине обнаружено примерно 6 таких различий в 580 положениях (King, Wilson, 1975*).
для разных пар гоминоидов (Brusse, Ayala, 1979*) | |
| Пара родов | I |
| Homo–Pan | 0.71 |
| Homo–Gorilla | 0.69 |
| Homo–Pongo | 0.71 |
| Pan–Gorilla | 0.68 |
| Pan–Pongo | 0.80 |
| Gorilla–Pongo | 0.63 |
| Homo–Hylobates | 0.46 |
| Homo–Symphalangus | 0.33 |
| Pan–Hylobates | 0.47 |
| Pan–Symphalangus | 0.39 |
| Gorilla–Hylobates | 0.58 |
| Gorilla–Symphalangus | 0.45 |
| Pongo–Hylobates | 0.56 |
| Pongo–Symphalangus | 0.45 |
Результаты электрофоретического анализа 23 гомологичных белков также указывают на близкое сходство между человеком и человекообразными обезьянами, как это видно по оценкам генетической идентичности, приведенным в табл. 32.4 (Bruce, Ayala, 1979*). Человек, шимпанзе (Pan), горилла (Gorilla) и орангутан (Pongo) образуют группу с высокими показателями генетической идентичности (I), варьирующими от 0.63 до 0.80 в разных парных сочетаниях. Гиббон (Hylobates) и сиаманг (Symphalangus) отличаются от этой группы более низкими значениями I и образуют вторую, собственную, группу (табл. 32.4; Bruce, Ayala, 1979*).
Некоторые исследователи приходят к выводу, что шимпанзе в общем ближе к человеку, чем к горилле. Однако при этом они пренебрегают другими признаками. Необходимо учитывать морфологические, поведенческие и экологические различия между Homo, с одной стороны, и Pan и Gorilla — с другой. По этим признакам Pan и Gorilla достаточно близки, так что было бы правомерно относить их к одному роду, тогда как Homo, несомненно, принадлежит к другому роду. Хромосомные данные также свидетельствуют о том, что человек и африканские человекообразные обезьяны относятся к разным группам (Miller, 1977*).
Таким образом, данные об эволюционном расстоянии между человеком, шимпанзе и гориллой, полученные на организменном и молекулярном уровнях, не совпадают. Как можно объяснить это несовпадение? Представляется вероятным, что человек и узконосые обезьяны Старого Света обладают одинаковыми потребностями в отношении физиологических процессов, регулируемых гемоглобином, цитохромом с, различными ферментами, выявляемыми электрофоретическими методами, и т. п. Иными словами, эволюция некоторых физиологических процессов достигла адаптивного плато для крупных гоминоидов на ранней стадии филогении этой группы, прежде чем такие роды, как Homo, Pan и Gorilla дивергировали от общего ствола, а в последующий период необходимость в дальнейшем изменении этих процессов была невелика. В более близкой к нам фазе филогении гоминоидов, однако, человек и узконосые обезьяны Старого Света эволюционировали по дивергентным направлениям в отношении местообитания, локомоции, диеты, коммуникации и т. п., а морфологические различия между ними представляют собой адаптации к их соответственным образам жизни.
Теория нейтральности
Теорию нейтральности для объяснения молекулярной эволюции впервые сформулировали Кимура (Kimura, 1968*), Кинг и Джукс (King, Jukes, 1966*); затем она получила развитие в ряде работ (Kimura, Ohta, 1971a, b; Kimura, 1979; 1981*), а недавно Кимура (Kimura, 1983*) посвятил её критическому рассмотрению целую книгу.
Эта теория в её современной формулировке утверждает, что «огромное большинство» молекулярных изменений, происходящих в процессе эволюции, селективно нейтральны или почти нейтральны. Это не означает, что затрагиваемые такими изменениями гены лишены функций. Функции у них могут иметься или могут отсутствовать. Идея состоит в том, что различные аллельные формы таких генов почти равноценны в селективном отношении (1983, с. 50*). Не утверждает Кимура также, что все молекулярные изменения нейтральны; согласно его теории, нейтрально большинство таких изменений (ibid, с. 54*).
Рассматриваются два обширных класса молекулярных изменений: полиморфизм белков и замены аминокислот. Ни те, ни другие в большинстве случаев не контролируются отбором. Полиморфизм белков по большей части не поддерживается уравновешивающим отбором. Генетически обусловленные замены аминокислот в большинстве случаев подвержены действию дрейфа.
Кимура (Kimura, 1983*) очень убедительно излагает теорию нейтральности. Вполне возможно, что многие молекулярные изменения нейтральны или почти нейтральны. Составляют ли они большинство или нет, ещё предстоит выяснить. Для того чтобы решить эту проблему, необходимо гораздо больше эмпирических данных.
Ряд изоформ ферментов у Drosophila melanogaster и у других организмов были изучены с физиологической точки зрения. Гены ферментов контролируют важные функции. А разные изоформы фермента связаны с различными физиологическими свойствами, проявляющимися в лабораторных условиях, которые, возможно, влияют на приспособленность (Johnson, 1974; Lavie, Nevo, 1982; Koehn et al., 1983*).
Кроме того, при полиморфизме по некоторым белкам у дрозофил и других организмов не наблюдается случайной географической изменчивости, чего следовало ожидать, если бы аллели были селективно нейтральны. Вместо этого в географическом распространении аллелей видны определённые направления, в том числе клинальные, что указывает на регулирование частоты аллелей отбором.
В нескольких благоприятных случаях полиморфизм одного и того же фермента изучали и в лабораторных, и в полевых условиях. Оказалось, что изоформы данного фермента проявляют значительные физиологические различия в лаборатории и упорядоченное географическое распространение в природе. Так обстоит дело в случаях алкогольдегидрогеназы и α-глицерофосфатдегидрогеназы у Drosophila melanogaster, лактатдегидрогеназы у рыбы Fundulus heteroclitus (Koehn et al., 1983*) и фосфоглюкомутазы у креветки Palaemon elegans (Nevo et al., 1984*).
Горстка примеров о ценных в селективном отношении аллелях ферментных генов не подрывает авторитет теории нейтральности. Следует указать, однако, что продемонстрировать как селективную нейтральность, так и селективную ценность вариантных форм данного гена далеко не просто; это требует больших усилий. Следует ли возложить такие усилия и бремя доказательств на селекционистов или же это должны сделать нейтралисты?
У некоторых травянистых растений два аллеля какого-либо гена могут различаться лишь по одному основанию: у одного аллеля в данном положении находится аденин, а у другого — гуанин. Было бы очень легко отбросить это различие как тривиальное или несущественное в функциональном отношении. Между тем растения, несущие первый аллель, чувствительны к гербициду атрацину, тогда как растения со вторым аллелем атрациноустойчивы (NRC Board, 1984*). Совершенно очевидно, что при наличии в среде атрацина это различие имеет существенное селективное значение.
Если функция любого данного варианта той или иной макромолекулы нам неизвестна, это само по себе не даёт нам права считать его нейтральным. Кроме того, возможно, что адаптивная роль этой макромолекулы может экспрессироваться только в определённой среде, что крайне затрудняет её выявление.
различных белков млекопитающих (Dayhoff, 1978*) | |
| Белок | Число РАМ-единиц за 100 млн. лет |
| Каппа-казеин | 33.0 |
| α-Цепь гемоглобина | 12.0 |
| β-Цепь гемоглобина | 12.0 |
| Миоглобин | 8.9 |
| Инсулин | 4.4 |
| Лактатдегидрогеназа | 3.4 |
| Цитохром с | 2.2 |
| Глутаматдегидрогеназа | 0.9 |
| Гистон Н2А | 0.5 |
Объяснение явлений покровительственной окраски и мимикрии у животных в свете теории отбора и адаптации в свое время было встречено скептически; по по мере накопления полевых и лабораторных данных в конечном счете становилось ясно, что точка зрения селекционистов верна. Другие категории явлений (например, механизмы цветков у растений и т. п.) также прошли через аналогичные стадии скептицизма и накопления фактов к триумфу адаптационизма. История обычно, по-видимому, оказывается на стороне селекционистов, и можно ожидать, что это произойдет и в случае исследований молекулярной эволюции (см. также Clarke, 1973*).
Я полагаю, что некоторые молекулярные изменения, происходящие в процессе эволюции, но не «огромное большинство» их, окажутся селективно нейтральными. Хотя такое предположение скромнее, чем утверждения теории нейтральности, оно, если его удастся доказать, послужит интересным дополнением к нашим знаниям.
Скорости молекулярной эволюции
Существуют различные способы измерения и выражения средней скорости изменения белковых молекул. Дейхоф (Dayhoff, 1972, 1978*) использует для этого число фиксированных точковых мутаций на 100 аминокислотных остатков (РАМ-единицы) за 100 млн. лет. Кимура (Kimura, 1983*) выражает скорость изменения как число аминокислотных замен на одно положение за один год.
Для каждого белка характерна своя определённая скорость изменения. Различные белки различаются по средней скорости эволюции. В табл. 32.5 приведены скорости, характерные для ряда белков млекопитающих. Гистомы очень консервативны. Цитохром с, инсулин и другие белки также довольно консервативны. В отличие от этих белков фибринопептиды обладают высокой скоростью эволюции — 90 РАМ-единиц за 108 лет (Dayhoff, 1972*). Гемоглобин занимает промежуточное-положение.
между человеком, собакой и другими позвоночными в сопоставлении со временем, прошедшим после их дивергенции (по данным Kimura, 1983*) | ||
| Пара видов | Аминокислотные различия, % | Время после дивергенции, млн. лет |
| 16.3 | 90 | |
| 19.1 | 140 | |
| 26.2 | 225 | |
| 24.8 | 300 | |
| 44.0 | 360 | |
| 48.6 | 410 | |
| 53.2 | 450 | |
| 23.4 | 140 | |
| 29.8 | 225 | |
| 31.2 | 300 | |
| 46.1 | 360 | |
| 47.9 | 410 | |
| 56.8 | 450 | |
При сопоставлении степени молекулярной дифференциации по данному белку между разными филетическими группами со временем, прошедшим после их дивергенции, обычно обнаруживается хорошая корреляция между изменением на молекулярном уровне и временем. Это можно проиллюстрировать на примере α-цепи гемоглобина у позвоночных (табл. 32.6). График зависимости числа аминокислотных замен от времени имеет вид прямой линии, из которой несколько выпадают только данные для курицы.
На основании подобных данных была сформулирована доктрина о постоянстве скоростей молекулярной эволюции, утверждающая, что для любого данного типа белка скорость изменения постоянна или почти постоянна во времени (Zuckerkandl, Pauling, 1965; Ohta, Kimura, 1971; Kimura, Ohta, 1971, 1972; Jukes, 1972; Kimura, 1983*). Термин «молекулярные часы» отражает эту предполагаемую размеренность молекулярной эволюции.
Кимура (Kimura, 1983*) рассматривает полное или почти полное постоянство скоростей молекулярной эволюции как веский аргумент в пользу теории нейтральности. Это постоянство было бы трудно объяснить, если считать, что молекулярные изменения контролируются отбором; если же считать, что они селективно нейтральны и фиксируются дрейфом генов, то оно соответствует ожиданиям (Kimura, 1983*).
Однако по мере распространения исследований скоростей молекулярной эволюции на другие виды макромолекул и группы организмов стали выявляться примеры непостоянных скоростей. Было проведено сравнение аминокислотной последовательности супероксиддисмутазы (СОД) — фермента, имеющегося у большинства эукариот— у восьми видов: представителей четырёх отрядов млекопитающих, одной рыбы, одного двукрылого и двух видов грибов. Различия последовательностей у этих видов были выражены в РАМ-единицах и других мерах дифференциации, после чего был построен график зависимости степени различий от приблизительного времени дифференциации соответствующих групп. Оказалось, что скорости изменения последовательностей непостоянны: за последние примерно 100 млн. лет молекулы СОД изменялись быстро, а на ранних стадиях филогенеза — по-видимому, очень медленно (Ayala, 1986*).
Заключение о постоянстве скоростей молекулярной эволюции» несмотря на то что оно подтверждается некоторыми эмпирическими данными, совершенно расходится с нашими знаниями о скоростях эволюции морфологических признаков, также основанных на эмпирических данных. Скорости эволюции морфологических признаков непостоянны во времени (гл. 29).
Следует отметить существенные различия методов определения эволюционных скоростей в молекулярных и палеонтологических исследованиях. Скорости молекулярной эволюции оцениваются путем сравнения современных форм, подобранных по времени их дивергенции. Это производят по следующей схеме:
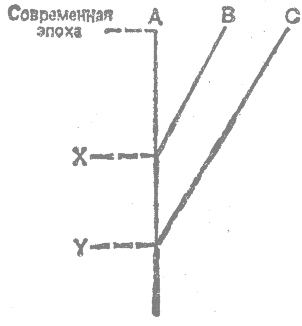
Различия между А и В сравнивают с различиями между А и С. Возраст различий между А и В равен интервалу Современная эпоха — X, а между А и С — интервалу Современная эпоха — Y. Если при этом обнаруживается, что две или более горизонтальные координаты (А—В и т. д.) изменяются прямо пропорционально соответствующим вертикальным координатам (Современная эпоха — X и т, д.), то делается заключение о постоянстве скоростей.
О скоростях морфологической и таксономической эволюции судят на основании изучения ряда датированных стадий в палеонтологической истории данной линии. Нередко, как это было показано в гл. 29, вначале, на стадиях формирования, линия эволюционирует с высокой скоростью, а на более поздних стадиях скорости эволюции снижаются до горотелических или брадителических. Можно ожидать, что для многих молекулярных изменений, имеющих адаптивное значение, характерна аналогичная последовательность. Такие варьирующие скорости молекулярной эволюции было бы, однако, трудно выявить с помощью очерченных выше стандартных подходов, применяемых при её изучении.
| i | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | ↑ |